Министерство образования и науки Российской Федерации
Федеральное Государственное автономное образовательное учреждение
высшего профессионального образования
Дальневосточный Федеральный Университет
Школа естественных наук
 |
|||
 |
|||
|
Выполнил студент гр. Б8321 ....................... ....................... 2014 г. |
|
Проверил ассистент кафедры химических и ресурсосберегающих технологий ………………………. ....................... 2014 г. |
|
................................................................. (зачтено/незачтено) |

Оглавление
Введение. 3
1. Уксусный ангидрид. 4
1.1. Получение. 4
1.2. Применение. 7
2. Уксусная кислота. 8
2.1. Получение. 8
2.2. Применение. 12
Список литературы.. 13
Уксусный ангидрид (СН3СО)2О – жидкость с резким специфическим запахом. С водой реагирует образую уксусную кислоту. Он растворим в бензоле, диэтиловом эфире, этаноле, хлороформе, уксусной кислоте, тетрагидрофуране и частично – в холодной воде.
Уксусный ангидрид применяется в качестве ацетилирующего средства. В больших количествах его используют для получения ацетата целлюлозы, перерабатываемого далее в ацетатное волокно, ацетатцеллюлозные лаки, пластические массы и негорючую кинопленку.
Уксусная кислота СН3СООН – бесцветная жидкость со специфическим резким запахом. Смешивается во всех отношениях с водой, эфиром, хорошо растворяет серу, фосфор, галоидоводороды. Безводная уксусная кислота является хорошим растворителем многих органических веществ. Уксусная кислота - весьма стабильное соединение: ее пары не разлагаются при нагревание до 400 °С; теплота сгорания 3490 ккал/кг. Пары уксусной кислоты действуют раздражающе па слизистые оболочки, особенно на слизистые оболочки глаз. Концентрированная уксусная кислота вызывает ожоги.
Уксусная кислота широко используется в химической, текстильной и пищевой промышленности, в производстве ацетата и других эфиров целлюлозы, пластических масс и т.д. Значительное применение имеют соли уксусной кислоты – ацетаты свинца и меди, используемые для приготовления пигментов, ацетат железа, ацетат натрия и т.д.
Метод получения уксусной кислоты путем термического расщепления ацетона не нашел применения в СССР, но аналогичным способом (через кетен) на отечественных заводах получается уксусный ангидрид.
Современные способы производства уксусного ангидрида основаны на взаимодействии уксусной кислоты с кетеном получаемым пиролизом ацетона или уксусной кислоты. Реакция протекает по схеме:
|
СН3-СООН+СН2=С=О→(СН3СО)2О |
(1) |
При синтезе уксусного ангидрида, исходя из ацетона, продукты пиролиза подают в скруббер, орошаемый уксусной кислотой, получаемой из ацетальдегида, или возвратной кислотой ацетатцеллюлозного производства.
Из уксусной кислоты ангидрид может быть получен непосредственной дегидратацией, без выделения промежуточного образующегося кетена:
|
|
(2) |
Частично наряду м гидратацией при этом происходит и расщепление уксусной кислоты:
|
СН3-СООН→СН4+СО2 |
(3) |
Катализаторами реакции дегидратации уксусной кислоты до кетена могут служить фосфорная кислота и ее кислые соли. Более эффективным является триэтилфосфат РО(ОС2Н5)3 – очень летучая жидкость.
Реакция дегидратации уксусной кислоты обратима. Для замедления обратной реакции гидратации к продуктам реакции добавляют азотистые основания.
При осуществлении процесса дегидратации в производственных условиях встретились большие трудности. Наиболее сложной задачей явилось своевременное отделение уксусного ангидрида от реакционной воды для предотвращения обратной реакции образования уксусной кислоты. Большие трудности были сопряжены также с подбором конструкциооных материалов, стойких к действию паров уксусной кислоты при 600-800°С. В настоящее время уксусный ангидрид получают в промышленных масштабах пиролизом уксусной кислоты в присутствии катализаторов с выделением в качестве промежуточного продукта кетена:
|
СН3-СООН↔СН2=С=О+Н2О |
(4) |
И с последующим взаимодействием кетена с уксусной кислотой:
|
СН2=С=О+СН3-СООН→(СН3СО)2О |
(5) |
На рисунке 1 изображена схема процесса получения уксусного ангидрида пиролизом уксусной кислоты.
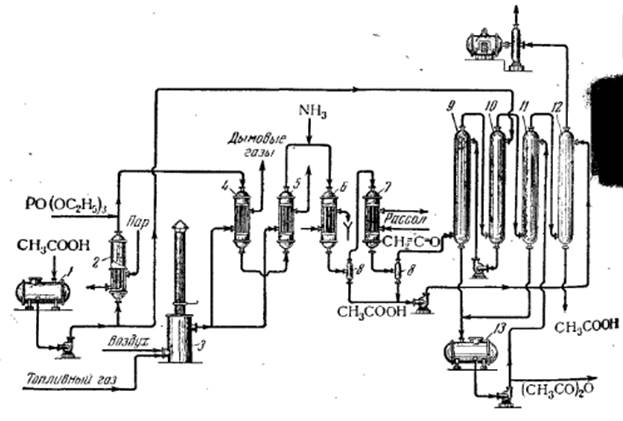
Рисунок 1. Схема производства уксусного ангидрида
1 – сборник уксусной кислоты; 2 – испаритель; 3 – топка; 4 – перегреватель паров; 5 – реактор; 6 – водяной холодильник; 7 – рассольный холодильник; 8 – сепаратор; 9,10,11,12 – абсорбционные колонны; 13 – сборник уксусного ангидрида; 14 – вакуум-компрессор.
При остаточном давлении 560 мм рт. Ст. испаряют кислоту, вводят в паровую фазу 0,2 вес. % триэтилфосфата и нагревают смесь до 600°С. Пиролиз проводят при 700-720°С в трубчатом реакторе 5 с газовым или электрическим обогревом. Реактор изготовлен из легированной стали(23% Cr, 2.5% Al, 1% Si).
К продуктам реакции, выходящим из аппарата 5, добавляют
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.