


















Monday, September 24, 2007
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
____________________________________________________
КРАТКИЙ КУРС ФИЗИЧЕСКОЙ ХИМИИ
Учебное пособие
для студентов технических вузов
(специальности технология пищевой промышленности)
Новосибирск
200
541. 18(07)
Б.Д. Краткий курс физической химии:
Учебное пособие.-
Новосибирск; Изд.- во НГТУ,
Рецензенты:
Работа подготовлена на кафедре химии
Новосибирский государственный
технический университет, 200 г.
ЧАСТЬ 1 СПЕЦИФИЧЕСКИЕ ОСОБЕННОСТИ ХИМИЧЕСКИХ
СИСТЕМ И ФИЗИКО- ХИМИЧЕСКИХ ПРОЦЕССОВ
Глава 1 Особенности химических систем
Глава 2. Основные положения химической термодинамики ……..
Глава 3. Химическаякинетика
3.1. Основные положения химической кинетики …….…
Глава 4. Природа химического равновесия
4.1. Основные понятия химического равновесия…..
4.2. Изотерма химической реакции ……
4.3. Изобара химической реакции ……………….
Глава 5. Термодинамика межфазовых переходов и равновесий ……
5.1 Осн. понятия и законы…..
5.2.Физико-химический анализ ………..
5.3 Отдельные процессы
5.3.1. Испарение и конденсация
5.3.2. Растворение ……………….
5.3.3.Экстрагирование ……..
Глава 6. Истинные растворы
6.1. Растворы неэлектролитов…..
6.2. Растворы электролитов……..
Глава 7. Механизм и кинетика химических реакций
7.2. Основные теории кинетики химических реакций …….
7.2.1. Кинетика простых химических реакций.....................
7.2.2. Основные стадии сложных химических реакций ….
7.2.3.Теории элементарного акта сложных химических реакций ….
7.2.4. Формальная кинетика………………………
7.2.5. Каталитические реакции ……………………
Глава 7. Электрохимические системы ……..
Список литературы …….
ПРИЛОЖЕНИЕ …………………………………………………………..
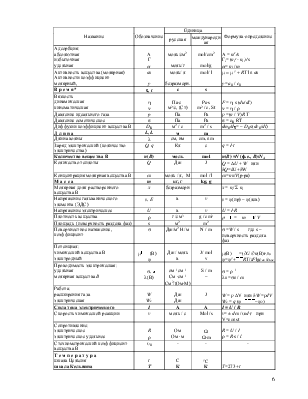
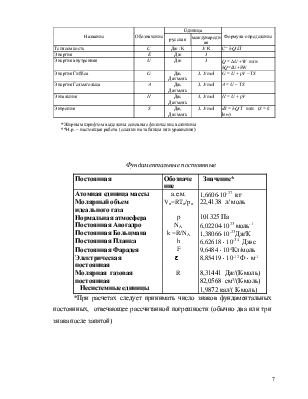
Важнейшие физико-химические величины и функции
|
Название |
Обозначение |
Единица |
Формула-определение |
|
|
русская |
международная |
|||
|
Адсорбция: абсолютная избыточная удельная |
А Г a |
моль/см2
моль/г |
mol/cm2
mol/g |
А = nis/s Гi= (nis - ni ) /s a= ni / m |
|
Активность вещества (молярная) Активности коэффициент молярный, |
aВ у |
моль/ л безразмерн. |
mol/ l |
m = m ° + RTln aВ у =аВ / cВ |
|
В р е м я* |
t, t |
c |
s |
|
|
Вязкость динамическая кинематическая |
h n |
Па×с м2/c, (Ст) |
Pa×s m2 / c, St |
F = h s (du/dl) n = h / r |
|
Давление идеального газа |
р |
Па |
Ра |
p =(n / V) RT |
|
Давление осмотическое |
p |
Па |
Ра |
p = cВ RT |
|
Диффузии коэффициент вещества В |
DB |
м2 / c |
m2 / s |
dmB/dt= – DB s(dcB/dl) |
|
Д л и н а |
L, L |
м |
m |
|
|
Длина волны |
l |
см, нм |
cm, nm |
|
|
Заряд электрический (количество электричества) |
Q, q |
Кл |
с |
q = I×t |
|
Количество вещества В |
n(В) |
моль |
mol |
n(В) =N (ф.е., В)/NA |
|
Количество теплоты |
Q |
Дж |
J |
Q = DU + W или dQ=dU+dW |
|
Концентрация молярная вещества В |
сВ |
моль / л, М |
mol / l |
сВ=nВ/V(р-ра) |
|
М а с с а |
m |
кг, г |
kg, g |
|
|
Молярная доля растворенного вещества В |
x |
безразмерн |
x = ni/ S ni |
|
|
Напряжение гальванического элемента (ЭДС) |
e, E |
в |
v |
e = j(пр) – j(лев) |
|
Напряжение электрическое |
U |
в |
v |
U = I×R |
|
Плотность вещества |
r |
г /см3 |
g / cm3 |
r = m / V |
|
Площадь (поверхность раздела фаз) |
s |
м2 |
m2 |
|
|
Поверхностное натяжение, коэффициент |
s |
Дж/м2 Н/ м |
N / m |
s =W / s где s – поверхность раздела фаз |
|
Потенциал: химический вещества В электродный |
m (В) j |
Дж / моль в |
J/ mol v |
m(В)=(¶G /¶n(В)P,T,n j=j°+RT/zFlgcoк /cвос |
|
Проводимость электрическая: удельная молярная вещества В |
s, æ l(В) |
ом–1см–1 См ×см–1 См2/(Ом×М) |
S / m – |
s = r–1 lВ =sB / cВ |
|
Работа: расширения газа электрическая |
W We |
Дж Дж |
J |
W = p DV или dW =pdV We = q (j–j2) |
|
Сила токаэлектрического |
I |
A |
A |
I = U / R |
|
Cкорость химической реакции |
v |
моль / c |
Mol /s |
v= ± dcВ /uВdtпри V=const |
|
Сопротивление: электрическое электрическое удельное |
R r |
Ом Ом ×м |
W W×m |
R = U/ I r = R×s/ l |
|
Стехиометрический коэффициент вещества В |
uВ |
- |
- |
- |
|
Т е м п е р а т у р а шкала Цельсия шкала Кельвина |
t Т |
C К |
°C К |
Т=273 +t |
|
Теплоемкость |
С |
Дж /K |
J/ K |
С= dQ/dT |
|
Энергия |
Е |
Дж |
J |
|
|
Энергия внутренняя |
U |
Дж |
J |
Q = DU +W или dQ=dU+dW |
|
Энергия Гиббса |
G |
Дж, Дж/моль |
J, J/mol |
G = U + pV – TS |
|
Энергия Гельмгольца |
А |
Дж, Дж/моль |
J, J/mol |
А = U – TS |
|
Энтальпия |
Н |
Дж, Дж/моль |
J, J/mol |
Н = U + pV |
|
Энтропия |
S |
Дж, Дж/моль |
J, J/mol |
dS = dQ/T или(S = k lnw) |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.