Таблица 7
Вещественный состав шихты, % (по массе)
|
Соед-е |
Всего |
Ni |
Cu |
Co |
Fe |
S |
O |
SiO2 |
Al2O3 |
CaO |
MgO |
Проч. |
|
Ni3S2 |
4,49 |
3,29 |
1,20 |
|||||||||
|
NiO |
1,18 |
0,93 |
0,25 |
|||||||||
|
Ni FeS2 |
1,83 |
0,60 |
0,57 |
0,66 |
||||||||
|
Cu2S |
2,77 |
2,21 |
0,56 |
|||||||||
|
Cu FeS2 |
0,99 |
0,34 |
0,30 |
0,35 |
||||||||
|
Co S |
0,02 |
0,01 |
0,01 |
|||||||||
|
CoO |
0,17 |
0,13 |
0,04 |
|||||||||
|
FeS |
11,42 |
7,25 |
4,17 |
|||||||||
|
Fe7S8 |
4,73 |
2,85 |
1,88 |
|||||||||
|
Fe2O3 |
10,63 |
7,43 |
3,20 |
|||||||||
|
Fe3O4 |
9,96 |
7,21 |
2,75 |
|||||||||
|
SiO2 |
27,52 |
27,52 |
||||||||||
|
Al2O3 |
5,23 |
5,23 |
||||||||||
|
CaO |
1,97 |
1,97 |
||||||||||
|
MgO |
14,34 |
14,34 |
||||||||||
|
прочие |
2,75 |
2,75 |
||||||||||
|
Итого |
100,00 |
4,82 |
2,55 |
0,14 |
25,61 |
8,83 |
6,24 |
27,52 |
5,23 |
1,97 |
14,34 |
2,75 |
1.4. Расчет степени десульфуризации новой шихты
Все справочные данные оставим те же, что принимали выше (извлечение цветных металлов в штейн: Ni – 97%, Cu – 95,7%, Co – 82,2%).
При плавке 100 кг шихты получается штейн, содержащий цветных металлов по массе:
Ni – 4,82∙0,970 = 4,68 кг
Cu – 2,55∙0,957 = 2,44 кг
Co – 0,14∙0,822 = 0,12 кг
![]() цветных металлов – 4,68+2,44+0,12 =
7,24 кг
цветных металлов – 4,68+2,44+0,12 =
7,24 кг
Сумму цветных металлов в штейне принимаем равной 22,3%. Следовательно, выход штейна равен:
m(штейна) = 7,24:0,223 = 32,47 кг
Содержание серы в штейне равно 25,1%.
m(S в шт) = 32,47∙0,251 = 8,16 кг
Таким образом, десульфуризация шихты равна:
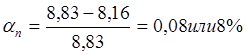
Такой процент десульфуризации оптимален в электропечи. Значит, проводим дальнейший расчет – расчет основных статей материального баланса электроплавки.
1.5. Расчет основных статей материального баланса электроплавки
Расчет проводим, учитывая, что 1,5% от массы шихты уходит в пыль.
1. 4CuFeS2 ® 2Cu2S + 4FeS + S2
m(CuFeS2) = 0,99-0,01 = 0,98 кг
4∙183,5 CuFeS2 - 2∙159,1 Cu2S
Þ х = mшт(Cu2S) = 0,42 кг
0,98 CuFeS2 – х Cu2S
m(Cu в Cu2S) = 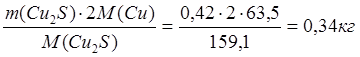 ;
;
m(S в Cu2S) = 0,08 кг.
4∙183,5 CuFeS2 - 4∙87,9 FeS
Þ х = m(FeS) = 0,47 кг
0,98 CuFeS2 – х FeS
m(Fe в FeS) = 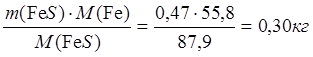 ;
;
m(S в FeS) = 0,17 кг.
m(S2) = 0,98–0,42–0,47 = 0,09 кг.
Всего в штейне содержится 2,44 кг Cu. По реакции диссоциации в него переходит 0,34 кг Cu. Следовательно, 2,1 кг Cu переходит в штейн вместе с Cu2S из исходной шихты.
mшт(Cu2S)
= 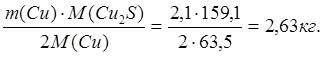
![]() ,
,
![]() (S в Cu2S)
= 0,08+0,53 = 0,61 кг.
(S в Cu2S)
= 0,08+0,53 = 0,61 кг.
2. CoO + Fe ® Co + FeO
Всего в штейне 0,12 кг Co.
mшт(Coмет) = 0,12 кг
m(CoO) = 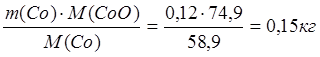
m(O в CoO) = 0,03 кг.
58,9 Co – 55,8 Fe
Þ х = m(Feмет) = 0,11 кг
0,12 Co – х Fe
m(FeO) = m(Feмет) + m(O в CoO) = 0,11+0,03 = 0,14 кг.
3. 6NiFeS2 ® 2Ni3S2 + 6FeS + S2
m(NiFeS2) = 1,83-0,03 = 1,80 кг
6∙178,7 NiFeS2 - 2∙240,3 Ni3S2
Þ х = mшт(Ni3S2) = 0,81 кг
1,80 NiFeS2 – х Ni3S2
m(Ni в Ni3S2) = 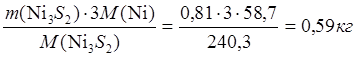 ;
;
m(S в Ni3S2) = 0,22 кг.
6∙178,7 NiFeS2 - 6∙87,9 FeS
Þ х = m(FeS) = 0,89 кг
1,80 NiFeS2 – х FeS
m(Fe в FeS) = 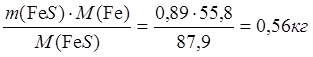 ;
;
m(S в FeS) = 0,33 кг.
m(S2) = 1,80–0,81–0,89 = 0,10 кг.
Весь Ni3S2 из шихты переходит в штейн:
mшт(Ni3S2) = 4,49-0,07 = 4,42 кг
mшт(Ni в Ni3S2) = 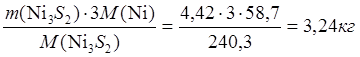 ;
;
mшт(S в Ni3S2) = 1,18 кг.
Всего в штейне содержится 4,68 кг Ni. По реакции диссоциации в него переходит 0,59 кг Ni, из исходной шихты с Ni3S2 – 3,24 кг. Следовательно, 0,85 кг Ni переходит в штейн из NiO.
m(Ni в NiO) = 0,85 кг
m(NiO) = 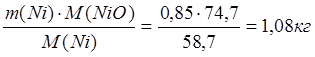
4. NiO + Fe ® Ni + FeO
На реакцию образования металлического никеля принимаем 50% от всей массы NiO.
m(NiO) = 1,08∙0,5 = 0,54 кг
mшт(Niмет) = m(Ni в NiO) = 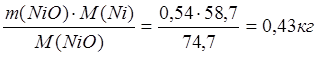 ;
;
m(O в NiO) = 0,11 кг.
58,7 Ni – 55,8 Fe
Þ х = m(Feмет) = 0,40 кг
0,43 Ni – х Fe
m(FeO) = m(Feмет) + m(O в NiO) = 0,40+0,11 = 0,51 кг.
5. 6NiO + 6FeS ® 2Ni3S2 + 2FeO + S2
На реакцию образования Ni3S2 принимаем 50% от всей массы NiO.
m(Ni в NiO) = 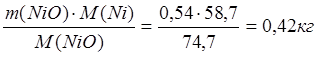 ;
;
m(O в NiO) = 0,12 кг.
6∙74,7 NiO – 6∙87,9 FeS
Þ х = m(FeS) = 0,64 кг
0,54 NiO – х FeS
m(Fe в FeS) = 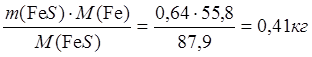 ;
;
m(S в FeS) = 0,13 кг.
6∙74,7 NiO - 2∙240,3 Ni3S2
Þ х = mшт(Ni3S2) = 0,58 кг
0,54 NiO – х Ni3S2
m(Ni в Ni3S2) = m(Ni в NiO) = 0,42кг
m(S в Ni3S2) = 0,16 кг.
m(FeO) = m(Fe вFeS) + m(O в NiO) = 0,41+0,12 = 0,53 кг.
m(S2) = 0,54+0,64–0,58–0,53 = 0,07 кг.
Суммарная масса Ni3S2 в штейне: 0,81+4,42+0,58 = 5,81 кг
mшт(Ni в Ni3S2) = 0,59+3,24+0,42 = 4,25 кг;
mшт(S в Ni3S2) = 1,56 кг.
![]()
6. 2Fe7S8 ® 14FeS + S2
m(Fe7S8) = 4,73-0,07 = 4,66 кг
2∙647,4 Fe7S8 - 14∙87,9 FeS
Þ х = m(FeS) = 4,43 кг
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.