Таблица 12
Получено
|
Эл-т Мат-л |
Всего |
Ni |
Cu |
Co |
Fe |
S |
O |
SiO2 |
CaO |
|||||||||
|
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
|
|
Штейн |
32,47 |
24,27 |
4,68 |
97,10 |
2,44 |
95,69 |
0,12 |
85,71 |
17,00 |
65,46 |
8,16 |
97,84 |
||||||
|
Шлак |
67,41 |
50,40 |
0,07 |
1,45 |
0,07 |
2,75 |
0,02 |
14,29 |
8,59 |
33,08 |
0,04 |
0,48 |
2,49 |
96,51 |
31,50 |
98,72 |
2,28 |
98,70 |
|
Пыль |
1,5 |
1,12 |
0,07 |
1,45 |
0,04 |
1,56 |
0,00 |
- |
0,38 |
1,46 |
0,14 |
1,68 |
0,09 |
3,49 |
0,41 |
1,28 |
0,03 |
1,30 |
|
Газ.фаза |
32,38 |
24,21 |
||||||||||||||||
|
Итого |
133,76 |
100 |
4,82 |
100 |
2,55 |
100 |
0,14 |
100 |
25,97 |
100 |
8,34 |
100 |
2,58 |
100 |
31,91 |
100 |
2,31 |
100 |
|
Эл-т Мат-л |
MgO |
Al2O3 |
SO2 |
CO2 |
CO |
C |
N2 |
Зола |
Проч. |
|||||||||
|
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
кг |
% |
|
|
Штейн |
0,07 |
2,36 |
||||||||||||||||
|
Шлак |
14,34 |
98,49 |
5,15 |
98,47 |
2,86 |
96,30 |
||||||||||||
|
Пыль |
0,22 |
1,51 |
0,08 |
1,53 |
0,04 |
|||||||||||||
|
Газ.фаза |
0,98 |
100 |
12,21 |
100 |
0,22 |
100 |
18,9 |
100 |
0,07 |
100 |
||||||||
|
Итого |
14,56 |
100 |
5,23 |
100 |
0,98 |
100 |
12,21 |
100 |
0,22 |
100 |
18,9 |
100 |
0,07 |
100 |
2,97 |
100 |
||
2. Тепловой баланс электроплавки
2.1. Расчет основных статей теплового баланса электроплавки
При расчете теплового баланса необходимо вычислить тепло, приносимое в печь исходными материалами и образующимися при протекании экзотермических реакций, а также тепло, выносимое из печи конечными материалами, уносимое газовой фазой, шлаком и штейном, а также поглощаемое эндотермическими реакциями.
Тепловые эффекты реакций рассчитываются как разность сумм произведений тепловых эффектов образования конечных продуктов реакции на их количество (число молей) и произведений тепловых эффектов образования начальных продуктов реакции на их количество. Тепловые эффекты образования химических веществ при заданной температуре рассчитываются по формуле:
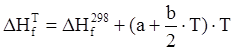 ,
,
где ![]() - тепловые эффекты образования
химических веществ при температуре 298 К, кДж/моль; a, b – термодинамические коэффициенты мольной теплоемкости,
Дж/моль∙К; Т – абсолютная температура, К.
- тепловые эффекты образования
химических веществ при температуре 298 К, кДж/моль; a, b – термодинамические коэффициенты мольной теплоемкости,
Дж/моль∙К; Т – абсолютная температура, К.
Чтобы рассчитать тепловой эффект реакции, в которой участвуют
определенные массы реагентов, необходимо умножить величину ![]() на коэффициент
на коэффициент 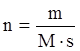 , где m –
масса одного из веществ, участвующих в химической реакции, г; М – молярная
масса этого вещества, г/моль; s – стехиометрический
коэффициент вещества в уравнении химической реакции.
, где m –
масса одного из веществ, участвующих в химической реакции, г; М – молярная
масса этого вещества, г/моль; s – стехиометрический
коэффициент вещества в уравнении химической реакции.
Принимаю, что химические реакции, протекающие в процессе плавки во
взвешенном состоянии идут при температуре 1300˚С (1573 К). Величины ![]() , a, b для каждого соединения находятся по химическому справочнику
термодинамических величин. Зная термодинамические функции химических веществ,
можно вычислить тепловые коэффициенты химических реакций, причем следует
учесть, что при отрицательном значении энтальпии тепло выделяется, т. е.
реакция экзотермическая; при положительном значении энтальпии – реакция эндотермическая.
, a, b для каждого соединения находятся по химическому справочнику
термодинамических величин. Зная термодинамические функции химических веществ,
можно вычислить тепловые коэффициенты химических реакций, причем следует
учесть, что при отрицательном значении энтальпии тепло выделяется, т. е.
реакция экзотермическая; при положительном значении энтальпии – реакция эндотермическая.
1. 4CuFeS2 ® 2Cu2S + 4FeS + S2
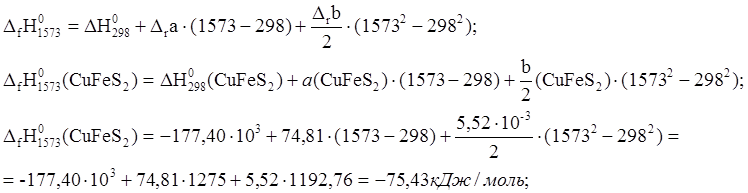
Аналогично рассчитываем тепловые эффекты для остальных веществ реакции:
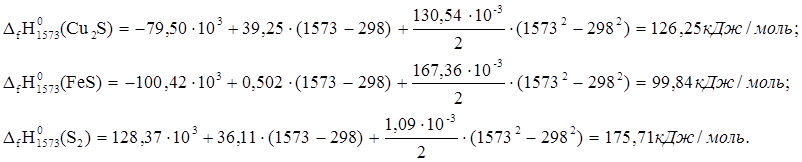
Рассчитываем тепловой эффект реакции:
![]()
Такое количество тепла потребуется для вступления в реакцию 4 молей CuFeS2. В реакцию вступило 0,98 кг CuFeS2.
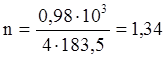 моль CuFeS2
моль CuFeS2
![]() кДж.
кДж.
2. CoO + Fe ® Co + FeO
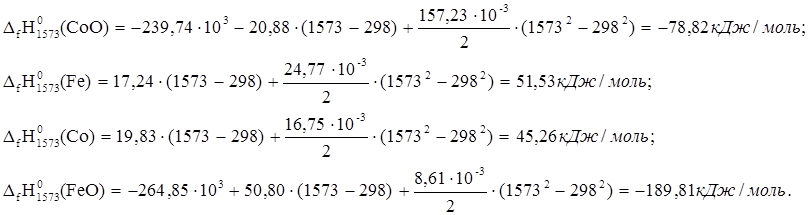
![]() ю
ю
Это тепло выделится при образовании 1 моля Co. В результате реакции образовалось 0,12 кг Сомет.
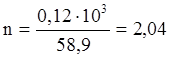 моль Cо
моль Cо
![]() кДж.
кДж.
3. 6NiFeS2 ® 2Ni3S2 + 6FeS + S2
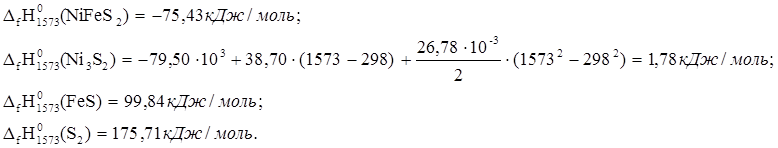
![]() ю
ю
Такое количество тепла потребуется для вступления в реакцию 6 молей NiFeS2. В реакцию вступило 1,80 кг NiFeS2.
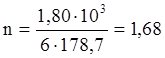 моль NiFeS2
моль NiFeS2
![]() кДж.
кДж.
4. NiO + Fe ® Ni + FeO
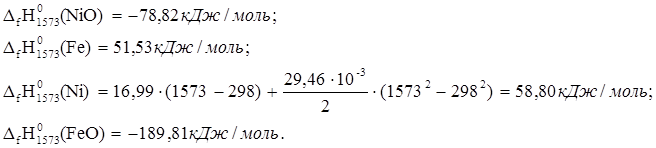
![]() ю
ю
Это тепло выделится при образовании 1 моля Ni. В результате реакции образовалось 0,43 кг Niмет.
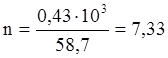 моль Ni
моль Ni
![]() кДж.
кДж.
5. 6NiO + 6FeS ® 2Ni3S2 + 2FeO + S2
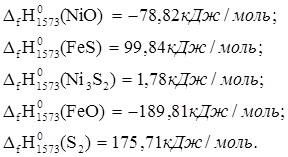
![]() ю
ю
Это тепло выделится при образовании 2 молей Ni3S2. В результате реакции образовалось 0,58 кг Ni3S2.
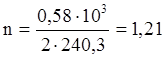 моль Ni3S2
моль Ni3S2
![]() кДж.
кДж.
6. 2Fe7S8 ® 14FeS + S2
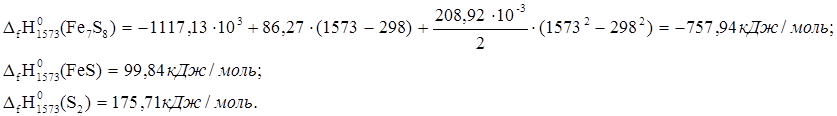
![]() ю
ю
Такое количество тепла потребуется для вступления в реакцию 2 молей Fe7S8. В реакцию вступило 4,66 кг Fe7S8.
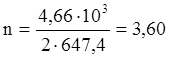 моль Fe7S8
моль Fe7S8
![]() кДж.
кДж.
7. Fe3O4 + CO ® 3FeO + CO2
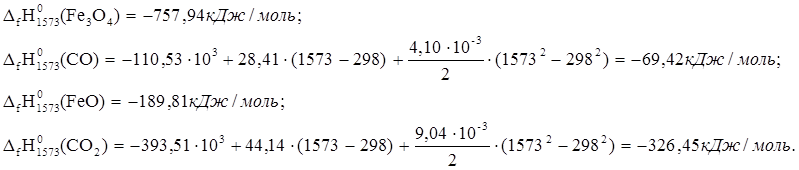
![]() ю
ю
Это тепло выделится при образовании 3 молей FeO. В результате реакции образовалось 9,13 кг FeO.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.