3 ИССЛЕДОВАТЕЛЬСКИЙ РАЗДЕЛ
3.1 Исследование коррозионной стойкости магнитно-электрических покрытий из высоколегированных наплавочных материалов.
Коррозией называют процесс разрушения металла под химическим или электрохимическим воздействием на него окружающей среды. Иными словами, коррозия — это процесс превращения металла в оксид или другие соединения посредством захвата валентных электронов, образующих металлическую связь. Этот процесс называют также окислением или анодной реакцией.
В водном растворе всегда есть ионы Н+ и OH- как продукты частичного распада воды, а также содержится то, или иное количество кислорода. При погружении в такой раствор железа его коррозия протекает в условиях образования микрогальванического элемента (рисунок 3.1).
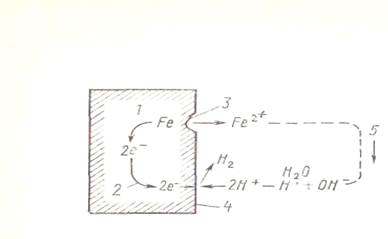
Рисунок 3.1 Гальванический микроэлемент. Схема электрохимического коррозионного процесса для сплавов на основе железа (в среде раствора):1-металл; 2-поток электронов;
3-анод; 4-катод; 5-ток.
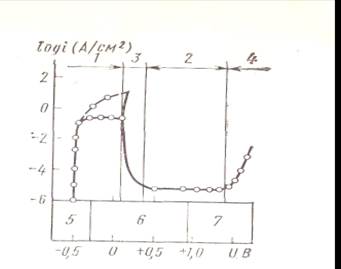
Рисунок 3.2 Кривая поляризации. Соотношение между логарифмом анодного тока и между электродным потенциалом: 1-активное состояние; 2-пассивное состояние; 3-переход из активного в пассивное состояние ; 4-перепассивация; 5-область возможного образования водорода; 6-область стабильного состояния; 7-область возможного образования водорода.
Процесс коррозии можно выразить с помощью химических реакций:
Fе→Fе2++2е- (анодная реакция);
2Н+ + 2е-→Н2
(катодная реакция)
02 + 4Н+ + 4е-→2Н20
Для образования гальванического элемента необходимо одновременное протекание катодной и анодной реакций; в случае прекращения какой-либо из этих реакций прекращается и развитие коррозии. Одной из причин прекращения указанных реакций является переход металла в пассивное состояние из-за образования поверхностной пленки, предотвращающей дальнейшее окисление (анодная поляризация). По мере повышения окислительных свойств раствора коррозия металла достигает максимальной активности, после чего происходит резкое снижение активности вплоть до почти полного прекращения коррозии. В электрохимическом выражении это явление можно продемонстрировать с помощью кривой поляризации. На рисунке 3.2 показана кривая поляризации для железа в водном растворе 1 N (5%) серной кислоты. При отрицательном электродном потенциале через раствор проходит анодный ток и соответственно возрастает скорость коррозии образца. При смещении электродного потенциала в положительную сторону в связи с активизацией образования оксидов железа более высокой валентности вся поверхность образца оказывается покрытой- оксидной пленкой, что приводит к резкому уменьшению тока коррозии. Образующаяся при этом пассивная оксидная пленка тормозит скорость коррозии железа. Коррозионно-стойкие стали дают пример эффективного использования пассивной оксидной пленки, образующейся в результате введения в состав стали хрома и никеля.
Коррозию классифицируют: 1) межкристаллитная коррозия; 2) коррозионное растрескивание под напряжением; 3) точечная коррозия; 4) щелевая коррозия; 5) коррозионная усталость; 6) высокотемпературная коррозия. Ниже рассмотрены отдельные виды коррозии по этой классификации.
1. Межкристаллитная коррозия. Нестабильность границ кристаллического зерна структуры металла создает благоприятные условия для образования вторичных фаз, ликвации и диффузии. Следовательно, при некоторых условиях на границах зерна может снижаться концентрация тех элементов, которые способствуют повышению коррозионной стойкости, и повышаться концентрация вредных примесей. В таких условиях границы зерна становятся участком преимущественного проникания коррозии, распространение которой вглубь металла сопровождается разрушением по границам зерна. Схема межкристаллитной коррозии (МКК) показана на рисунке 3.3.
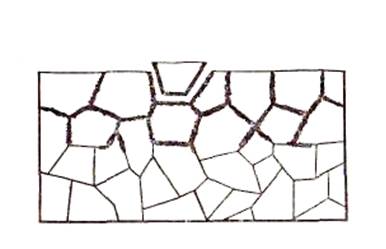
Рисунок 3.3 Модель межкристаллитной коррозии.
Для выявления МКК коррозионно-стойкой стали ее подвергают нагреву до некоторой температуры, составляющей 450—850°С для аустенитной (коррозия этой стали возникает после кратковременной выдержки при этой температуре) и выше 900°С для ферритной стали (после нагрева этой стали необходимо быстрое охлаждение).
МКК сопровождается образованием карбида хрома (Сг23С6) по границам зерна, вследствие чего вблизи границ образуется зона пониженного содержания хрома, большая часть которого поглощается карбидом (рисунок 3.4).
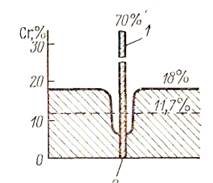
Рисунок 3.4 Зона пониженного содержания хрома около границы кристаллического зерна: 1- более70% хрома в составе карбида; 2-граница зерна.
Таким образом, задача
предотвращения МКК наплавленного металла требует использования аустенитной
коррозионно-стойкой стали с пониженным содержанием углерода или стали со
стабилизированной структурой, образованной ![]() путем введения в ее состав ниобия или других
элементов, стабилизирующих углерод. Предотвращение МКК требует также снижения
содержания фосфора и других примесей.
путем введения в ее состав ниобия или других
элементов, стабилизирующих углерод. Предотвращение МКК требует также снижения
содержания фосфора и других примесей.
К числу элементов, способствующих развитию МКК аустенитной коррозионно-стойкой стали, относятся углерод, молибден, фосфор и некоторые другие. При незначительном содержании кремний также ускоряет МКК, но при его содержании выше некоторого предела он способствует повышению стойкости стали к указанной коррозии. Содержание никеля в стали необходимо согласовывать с концентрацией углерода, при низком уровне которого допустимо повышение содержания никеля. Согласно сообщениям, молибден способствует развитию МКК за счет образования σ-фазы и других интерметаллических соединений [8].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.