





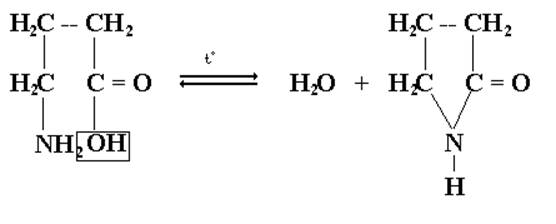
4-аминобутановая γ – лактам аминокислота бутановой кислоты
Легкость протекания таких реакций обусловлена повышенной термодинамической устойчивостью пяти- и шестичленных циклических соединений. Лактоны и лактамы в кислой или щелочной средах гидролизуются с образованием исходных гидрокси- или аминокислот или их солей. Незамещенные по азоту лактамы являются простейшими соединениями, для которых принципиально возможна лактам-лактимная таутомерия:
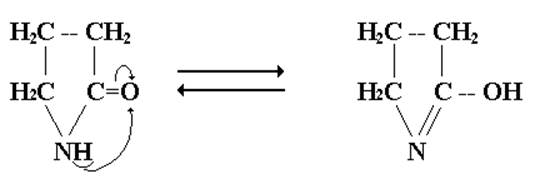
лактам лактим
Тема: «БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ»
Содержание темы.
1. Оксогруппа >C=O, ее электронное строение.
2. Реакции нуклеофильного присоединения (реакции со спиртами, с циановодородной кислотой).
3. Реакции присоединения-отщепления (реакции с аммиаком и аминами).
4. Реакции альдольного присоединения (альдольной конденсации).
5. Реакции диспропорционирования (реакция Каниццаро).
Соединения, содержащие карбонильную группу>C=O, в зависимости от характера связанных в ней заместителей, делятся на следующие классы: альдегиды, кетоны, карбоновые кислоты и их функциональные производные.
Электронное строение оксо- группы и характеристика реакционной способности альдегидов и кетонов.
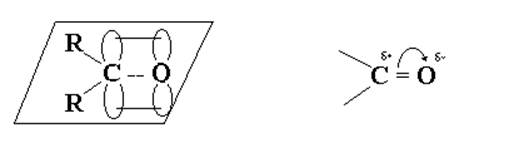
Частицы, которые могут действовать как доноры электронной пары по отношению к положительно заряженному атому углерода, называются нуклеофильными реагентами (нуклеофилами). В качестве нуклеофилов могут быть как анионы, то есть частицы с полным отрицательным зарядом (например, Нˉ, Clˉ, OHˉ), так и нейтральные молекулы. В этом случае их нуклеофильность обусловлена наличием свободной пары электронов у гетероатома (H2O, NH3, ROH, RNH2) или π-электронов (CH2 – CH2, C6H6).
1. Присоединение спиртов.
Спирты при взаимодействии с альдегидами легко образуют полуацетали. При обработке полуацеталей избытком спирта в кислой среде получаются ацетали.
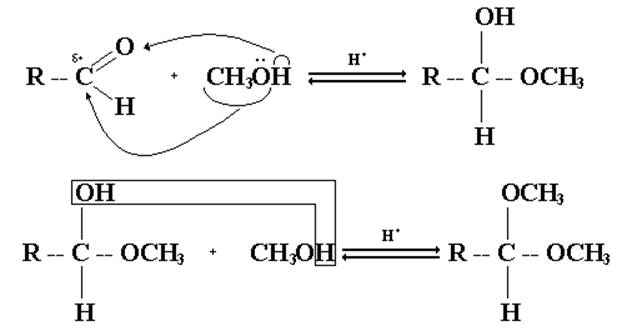
Для повышения активности атома углерода оксо- группы используют кислотный катализатор, приводящий к образованию карбокатиона:
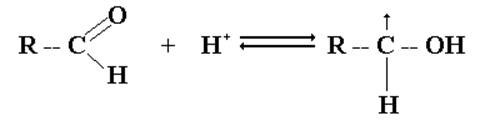
карбокатион
Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы.
Если оксогруппа и гидроксильная группа принадлежат одной молекуле, то, возможно, их внутримолекулярное взаимодействие, приводящее к образованию циклических полуацеталей.
Так, углеродная цепь 5-гидроксигексаналя имеет клешневидную конформацию, в результате чего в пространстве сближены атомы углерода С1 и С5. Так, при этих атомах углерода имеются реакционноспособные группы, то их взаимодействие и приведет к образованию циклического полуацеталя (получается термодинамически устойчивый шестичленный цикл, называемый пиранозным циклом).
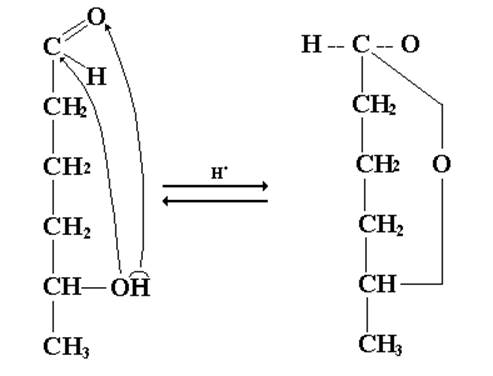
5-гидроксигексональ циклический полуацеталь
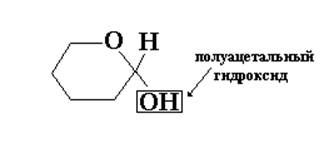
пиранозный цикл
По химической природе все циклические формы моносахаридов являются циклическими полуацеталями, а многократно повторенная реакция образования циклических ацеталей лежит в основе получения природных полисахаридов: крахмала, целлюлозы.
2. Присоединение циановодородной кислоты.
В присутствии щелочи циановодородная кислота присоединяется к альдегидам и кетонам с образованием α-гидроксинитрилов.
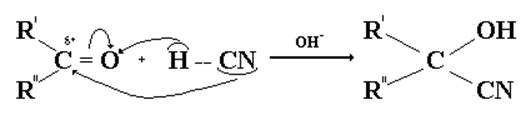
Щелочь, используемая в качестве катализатора, необходима для получения из слабой малодиссоциированной циановодородной кислоты активного нуклеофила CNˉ.
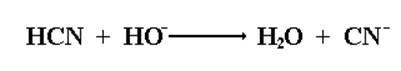
В кислой водной среде гидроксинитрилы превращаются в α-гидроксикислоты.
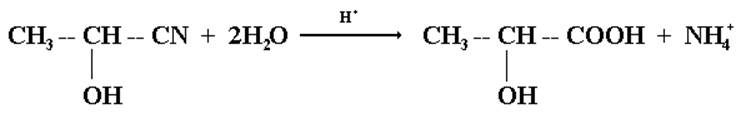
2-гидроксннитрил пропановой 2-гидрокснитрилпропановая кислоты (молочная) кислота
В организме (in vivo) гидроксинитрил бензальдегида с помощью фермента расщепляется с выделением исходных продуктов:
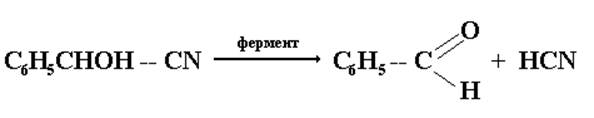
Поэтому употребление растительной пищи, содержащей гидроксинитрилы (косточки горького миндаля), может привести к отравлению вследствие высвобождения циановодородной кислоты.
3. Присоединение аммиака и аминов.
Аммиак и амины реагируют с альдегидами и кетонами в две стадии. Сначала, образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. Поэтому данный процесс классифицируют как реакцию присоединения-отщепления.
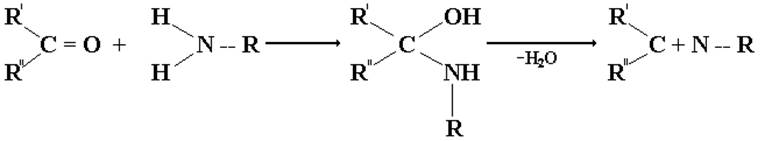
При взаимодействии оксосоединений с аммиаком образуются неустойчивые незамещенные имины, при взаимодействии с аминами- сравнительно устойчивые замещенные имины, или основания Шиффе:
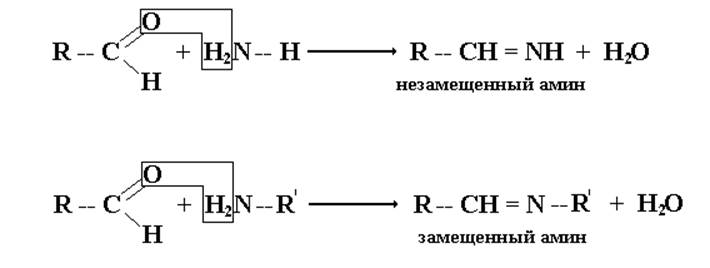
Имины – промежуточные продукты во многих ферментативных процессах, например, биосинтезе α-аминокислот в организме.
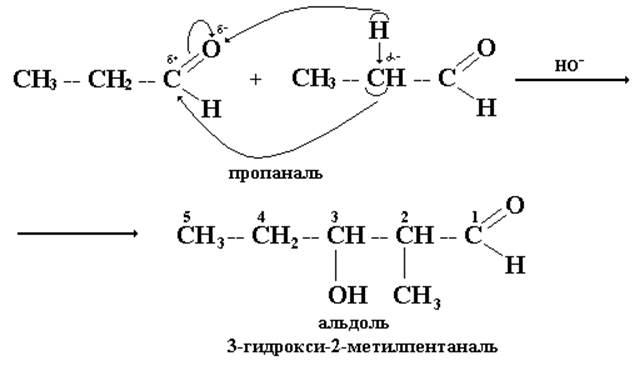
4. Реакции альдольной конденсации.
Под действием каталитических количеств щелочи альдегиды превращаются в β-гидроксиальдегиды с более сложным углеродным скелетом. Этот процесс называется альдольной конденсацией.
Кроме поляризованной оксогруппы в молекулах альдегидов имеется еще один реактивный центр - α-углеродный атом, при котором водородные атомы обладают некоторой протонной активностью.
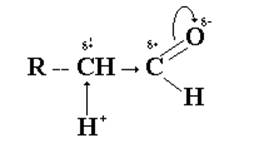
Под действием основания такие протоны могут отщепляться с образованием соответствующих карбанионов. Последние играют роль нуклеофилов по отношению к карбонильной группе другой молекулы альдегида. Оказывается возможной реакция, в которой одна молекула альдегида присоединяется к оксогруппе другой молекулы альдегида.
Для альдегидов, не имеющих водородного атома у α-углеродного атома (бензальдеггид, матаналь, 2,2-диметилпропаналь и т.д.) в присутствии щелочного катализатора характерна реакция диспропорционирования (реакция Каниццаро). Эта реакция является окислительно-восстановительной. В результате ее одна молекула альдегида восстанавливается до первичного спирта, а вторая до соответствующей карбоновой кислоты.
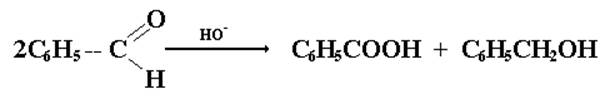
бензальдегид бензойная бензиловый кислота спирт
Для метаналя, атом углерода, оксогруппы которого более электрофилен по сравнению с другими альдегидами, из – за отсутствия электродонорных радикалов, реакция диспропорционирования осуществляется не только в щелочной, но и в обычной водной среде:
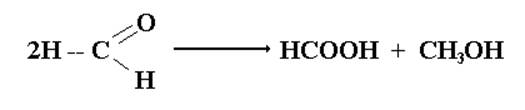
метаналь метановая метанол кислота
Образующаяся метановая (муравьиная) кислота сообщает раствору метаналя (формалина) кислую реакцию. Поскольку в гистологии используется нейтральный формалин, необходимо нейтрализовать его перед употреблением.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.