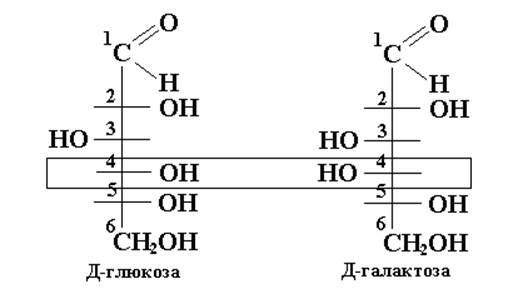
В организме (in vivo) под действием ферментов (эпимераз) происходит эпимеризация моносахаридов чаще всего по С4 ,например, из Д-глюкозы получается Д-галактоза.
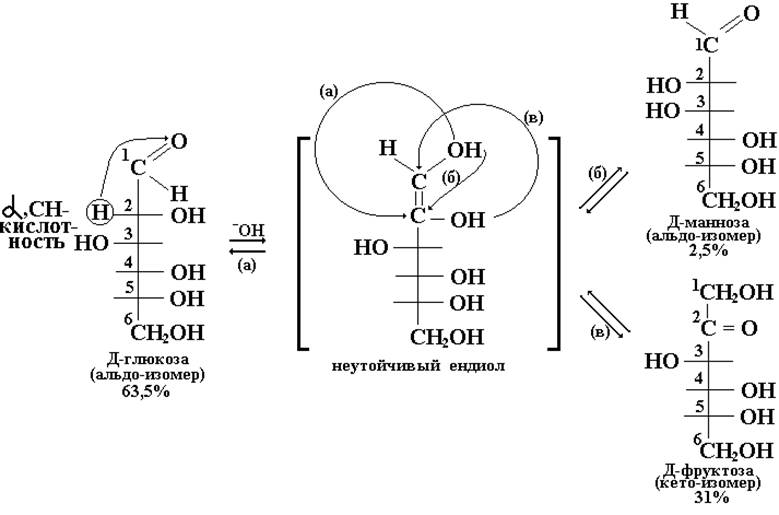
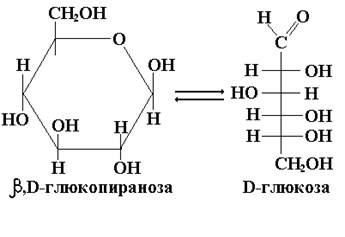
В условиях in vitro (в пробирке) эпимеризация наблюдается в щелочной среде, в которой моносахариды находятся преимущественно в ациклической (оксо) форме, и заключается в образовании равновесной смеси изомеров. Так например, если в раствор глюкозы добавить гидроксид натрия, то через некоторое время в растворе кроме глюкозы обнаруживаются ее изомеры:эпимерная альдоза – манноза и кетоза – фруктоза.
Явление эпимеризации связанно с подвижностью водородного атома в α-положении относительно оксо-группы. В слабощелочной среде катализируется кето-енольное превращение альдозы в ендиольную форму. При обратном переходе ендиольной формы в кето-форму, в соответствии с тремя вариантами такого перехода (а, б, в), образуется смесь трех моносахаридов: двух эпимерных по С2 альдоз и одной кетозы (с оксо-группой у С2).
Основные реакции моносахаридов, продукты реакций и их свойства
1. Реакции циклических форм моносахаридов.
1)Реакции полуацетального гидроксила.
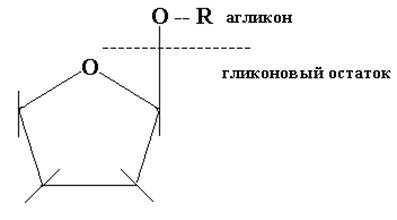
Как уже отмечалось, моносахариды,как в кристаллическом, так и в растворе (нейтральном и слабокислом), в основном, существуют в полуацетальных формах. Полуацетальный гидроксил таутомерных циклических форм, обладая высокой реакционной способностью, образует гликозиды в реакциях с гидроксильной группой спиртов, фенолов и других гидроксипроизводных . Эти гликозиды называют О-гликозидами, поскольку их неуглеводная часть молекулы, агликон,связана с сахаром через кислород:
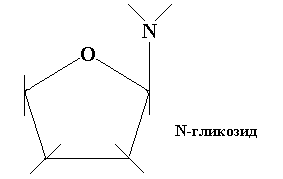
Реже встречаются построенные по тому же типу N-гликозиды и S-гликозиды.
Гликозиды могут существовать в виде α- и β-изомеров в зависимости от положения гликозидной гидроксильной группы.
Реакция моносахаридов со спиртами, фенолами и другими гидроксипроизводными:
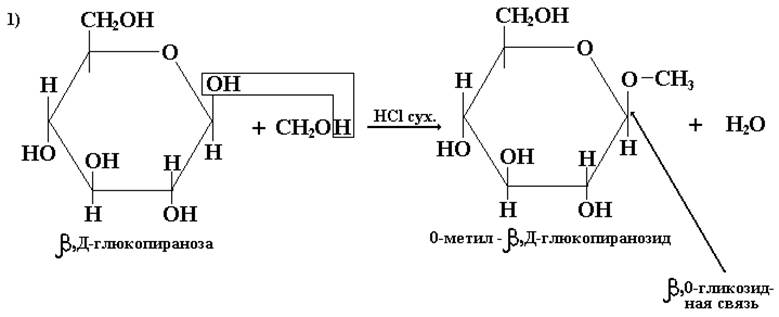
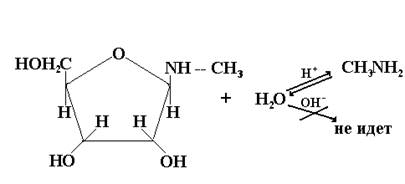
Реакция моносахаридов с аминами:
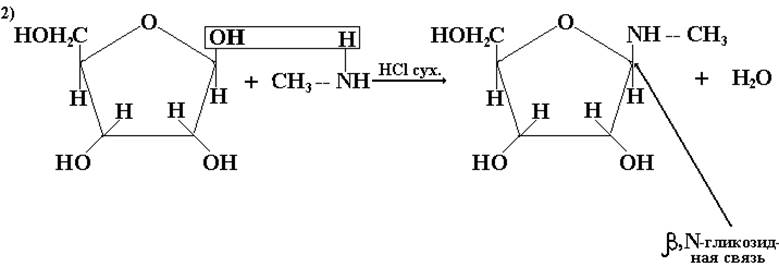
Вназвании гликозидов сначала указывается атом, через который осуществляется связь с углеродом (О- или М-), затем – название агликона (метил), далее α- или β-положение, ряд и название углевода, название цикла и окончание –озид (вместо –оза). Не имеющие свободного полуацетального гидроксила гликозиды не мутаротируют.
Условия для получения гликозидов in vitro должны быть такими, чтобы предотвратить гидролиз гликозидной связи (НСl сух.), так как образование и гидролиз гликозидов, идущих по механизму образования ацеталей, катализируются кислой средой.
Таким образом, О- и N-гликозиды, являясь ацеталями, получаются и гидролизуются в кислой среде, но устойчивы к щелочному гидролизу:
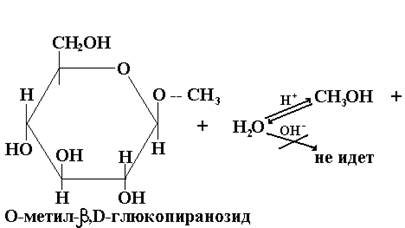 Гидролиз гликозидов
Гидролиз гликозидов
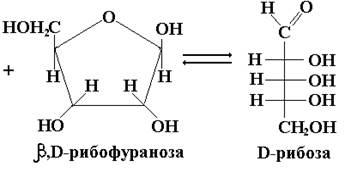
Природные О-гликозиды, большинство из которых образуется в результате жизнедеятельности растений, существуют преимущественно в β-форме. К N-гликозидам принадлежат исключительно важные в обмене веществ продукты расщепления нуклеиновых кислот и нуклеопротеидов (нуклеотиды и нуклеозиды), АТФ, НАД, НАДФ, некоторые антибиотики и т. п.
2) Реакции всех функциональных групп.
В более жестких условиях в реакцию вступают все гидроксильные группы моносахаридов. Из них наиболее важны реакции алкилирования (образования простых эфиров) и реакции ацилирования (образования сложных эфиров).
а) Реакция алкилирования.
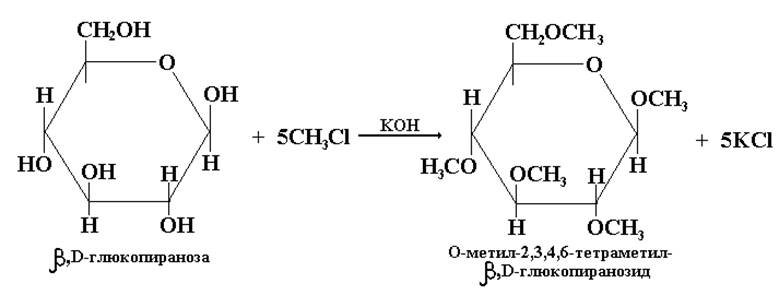
Алкилирующими агентами в реакциях образования простых эфиров по всем ОН-группам моносахарида служат более реакционноспособные, чем спирты, галогенпроизводные алканов R-Gal (δ+СН3 ® Сl –метилирующий агент; С2Н5 ® Сl – этилирующий агент и т.д.)
Например, получение продукта полного метилирования глюкозы:
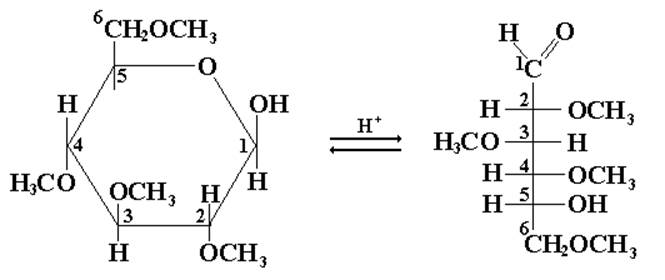
Гидролиз продуктов полного алкилирования моносахаридов проходит только по гликозидной связи:
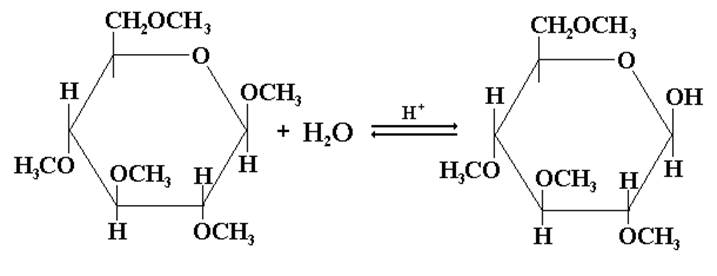
Образующаяся после гидролиза 2,3,4,6-тетраметил-β,Д-глюкопираноза способна к мутаротации:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.