 Активность
витамин В6 зависимых ферментов зависит от обеспеченности этим витамином, на
которую могут оказывать влияние некоторые лекарственные препараты. Например, изониазид,
применяемый в лечения туберкулеза, может взаимодействовать с
пиридоксалем и делать его недоступным для использования в клетке. Активность
трансаминаз при этом значительно снижается. Пенициламин, используемый
для лечения болезни Вильсона, при которой нарушается обмен меди, также способен
связывать пиридоксаль. При лечении этими препаратами больным необходимо
дополнительное введение витамина B6 для нормализации трансаминазной активности.
Активность
витамин В6 зависимых ферментов зависит от обеспеченности этим витамином, на
которую могут оказывать влияние некоторые лекарственные препараты. Например, изониазид,
применяемый в лечения туберкулеза, может взаимодействовать с
пиридоксалем и делать его недоступным для использования в клетке. Активность
трансаминаз при этом значительно снижается. Пенициламин, используемый
для лечения болезни Вильсона, при которой нарушается обмен меди, также способен
связывать пиридоксаль. При лечении этими препаратами больным необходимо
дополнительное введение витамина B6 для нормализации трансаминазной активности.
Распределение отдельных трансаминаз носит органоспецифический характер, что позволило использовать определение активности этих ферментов в плазме крови при диагностике некоторых заболеваний. Повышение активности отмечается при инфаркте миокарда (AСТ), гепатитах (АСТ,АЛТ), алкогольных повреждениях печени (АСТ,АЛТ), раке печени (АСТ,АЛТ), мышечной дистрофии(АСТ). Понижение активности при пищевой недостаточности пиридоксина, беременности, состояниях после гемодиализа.
Большинство трансаминаз используют в качестве акцептора аминогруппы a- кетоглутарат и образуют глутаминовую кислоту. Окислительное дезаминирование этой кислоты с образованием a- кетоглутарата и аммиака катализируется широко распространенной в тканях глутаматдегидрогеназой. Она представляет олигомерный фермент с молекулярной массой 312 кД, состоящий из 6 субъединиц, которые при определенных условиях (под влиянием НАД+ илиГТФ) способны к диссоциации с потерей глутамат дегидрогеназной активности, обладает высокой активностью, локализована в митохондриях и может использовать в качестве кофермента НАД или НАДФ. Работой этого фермента завершается непрямое качестве кофермента НАД или НАДФ. Работой этого фермента завершается непрямое дезаминирование многих аминокислот и аммиак, высвобождаемый в этой реакции, протекающей в печени, используется для синтеза мочевины.
![]()
Глутаматдегидрогеназа –аллостерический фермент и ее активность тщательно регулируется. Аллостерическими ингибиторами фермента являются АТФ, ГТФ и НАДН+Н+, а активатором является АДФ. Этот фермент катализирует и обратную реакцию, обеспечивая аминирование a-кетоглутаровой кислоты свободным аммиаком, что важно в механизмах обезвреживания аммиака и позволяет использовать азот аммиака для синтеза аминокислот.
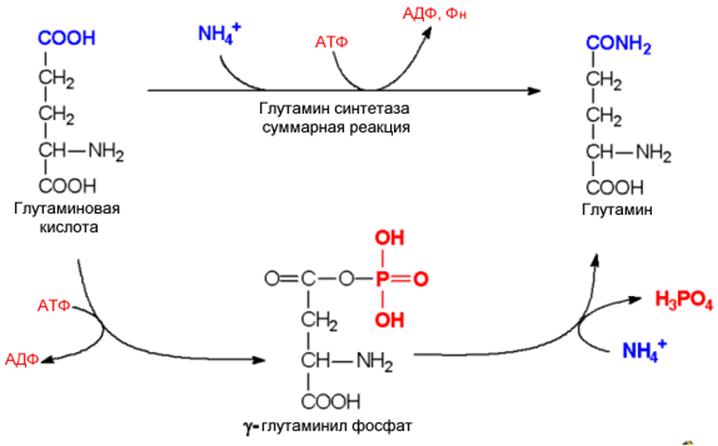 |
. Механизм глутаминсинтетазной реакции
тяжелых случаях к развитию коматозного состояния. Лечебные мероприятия при этом направлены на уменьшение уровня аммиака в крови. В нормальных условиях уровень аммиака в крови не превышает 200мкг/л, хотя процессы дезаминирования протекают во всех тканях. Такой низкий уровень поддерживается благодаря локальному связыванию аммиака в каждой клетке. Этому служат две реакции. Одна из них – восстановительное аминирование a-кетоглутарата представляет реакцию обратную уже упомянутой выше реакции, катализируемой глутаматдегидрогеназой. . Роль донора водородов в этой реакции выполняет НАДФН. (Глутаматдегидрогеназа не обладает выраженной специфичностью к коферменту, что характерно для других никотинамидзависимых дегидрогеназ). Вторая реакция – образование глутамина, катализируется глутаминсинтетазой.
Реакция протекает в цитозоле клеток всех тканей, но особенно высокой активностью характеризуется ткань мозга, где эта реакция является основной при связывании аммиака и поэтому в случае повышения уровня аммиака в циркулирующей крови, когда возможности глутаминсинтетазы мозга исчерпываются, для обезвреживания привлекается глутаматдегирогеназная реакция. Это сопряжено с «утечкой» a-кетоглутарата из цикла трикарбоновых кислот и ослаблением активности последнего, что приводит с ухудшению энергоснабжения нервных клеток и рассматривается как одна из причин аммонийной интоксикации.
Высокой глутаминсинтетазной активностью отличаются и мышцы. Глутаминсинтетаза характеризуется низкими значениями Км для аммиака, что позволяет ей активно выполнять свою функцию при низких концентрациях аммиака. У глутамина много функций:
· Во всех тканях глутамин является донором азота для синтеза важных молекул, в частности, для пуринового и пиримидинового синтеза.
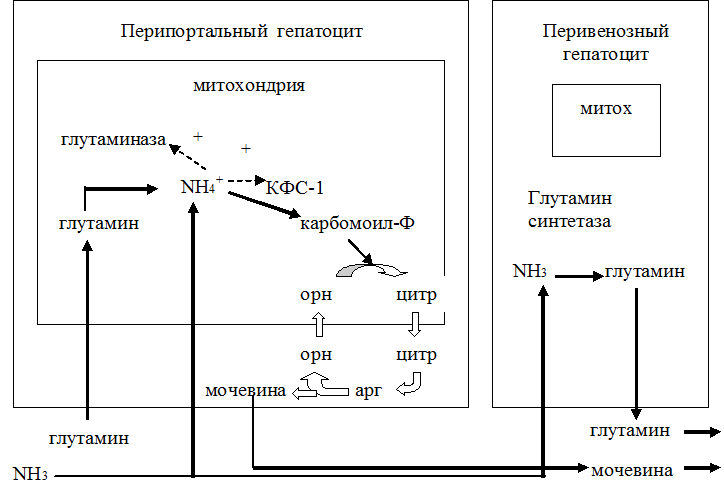
· Является нетоксичной формой транспорта аммиака из разных тканей к клеткам печени, где он превращается в мочевину.
· В кишечнике служит источником энергии для энтероцитов .
· В почках участвует в поддержании кислотно-щелочного равновесия. Гидролиз амидной группы в боковой цепи глутамина глутаминазой позволяет связывать протоны. Это особенно важно в условиях метаболического ацидоза.
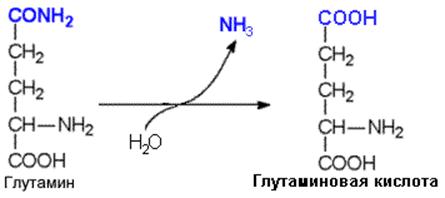
Глутамин может стать источником свободного аммиака благодаря глутаминазе – ферменту, который катализирует гидролиз амидной связи глутамина.
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.