N2O чрезвычайно химически инертен, мало растворим в воде. Таким образом он равномерно распределяется во всей толще тропосферы и имеет продолжительность жизни в тропосфере ~100 лет.. Благодаря инертности, устойчивости он легко проникает (переносится)в стратосферу где:
а) Может претерпевать фотодиссоциацию
![]()
б) Или взаимодействует с ат O(1d):
![]() -
этот процесс основной, приводящий к образованию NO стратосфере.
-
этот процесс основной, приводящий к образованию NO стратосфере.
Кроме того в качестве источника NO рассматривается звуковая высотная авиация – NO содержится в отработавших газах авиационных турбин
В принципе роль NO в химии стратосферного озона – двойная. В нижней части стратосферы (близи термопаузы) NO включается в реакции, аналогичные тем, что протекают у земной поверхности, которые сопровождаются образованием озона.
Но на высоте около 20 км NO включается в цикл разрушения озона.
Атомарный хлор
Главный источник атомарного хлора – антропогенный. Атомарных хлор образуется в результате фотохимического разрушения фреонов (фторхлорметанов или ФХУ), применяющихся в качестве хладоагентов (их др.название хладоны) в холодильных установках, кондиционерах и в качестве пропеллентов (средств для образования аэрозолей) в аэрозольных баллончиках, пенных огнетушителях.
Наиболее широко распространенными фреонами является CF2Cl2 (фреон 12) и CFCl3 (фреон 11). (применительно к производству фреон 12 составляет 85% всей мировой продукции F-содержащих соединений)
В молекулы некоторых фреонов так же включен Br наряду с ат. Cl или вместо него – эти вещества называются галлоны (вместо фреонов), например CF2ClBr – гало 1211, CF3Br – галлон 1301
Фреоны химически инертны и очень устойчивы с нижних слоях атмосферы время их жизни в тропосферы ~ 80 лет, таким образом постепенно они (как и N2O) м.б. перенесены в стратосферу.
В стратосфере ( в средних слоях) ХФУ фотохимических разлатапется под действием света с l<214 нм.
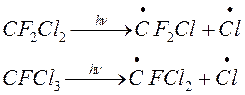
Наряду с фреонами
(антропогенного происхождения) в стратосферу спосолен проникать и давать ат Cl природных Cl-содержащий компонент CH3Cl –
он выделяется в больших количествах из морской воды, при вулканической
дятельности, при горении биомассы ( в результате рекомбинации ![]() )
)
Потенциальная роль отдельных частиц, участвующих разрушении озона, видна из сравнения значений констант скоростей их реакций с озоном (при одной температуре)
|
K, см3/молекул×с |
|
|
|
8×10-12 |
|
|
6,7×10-14 |
|
|
2,5×10-15 |
|
|
5×10-16 |
Таким образом наиболее активен в этом процессе ат Cl – его константа скорости на 2-3 порядка выше константы скорости других катализаторов.
Систематические наблюдения, проводимые с середины 70-х годов, указывают на существенное изменение в озоновом слое – снижение концентрации озорна. Учитывая отмеченные факты в качестве гл причины рассматривают поступление в стратосферу фреонов.
Образующиеся при фотолизе фреонов атом Cl имеет «сток» из стратосферы (процесс удаления) по реакции с CH4:
![]()
Исследования отмечают увеличение концентрации HCl в стратосфере, что свидетельствует в пользу ведущей роли фреонов в разрушении озона. Реакция Cl с CH4 разрушает «хлорный» цикл, поскольку HCl неактивен по отношению к озону, но он может быть источником активной формы по реакции с гидроксилом:
![]()
Поэтому HCl относят к так называемым «резервуарным» газам. К образованию «резервуарных» газов приводят и реакции ClO – промежуточная компонента хлорного цикла:
![]() -
нитрат оксида хлора
-
нитрат оксида хлора
![]()
Их фотохимическое разложение генерирует ClO и атомарный хлор – активные к озону частицы.
![]()
![]()
Сходным образом с фреонами ведут себя галлоны – Cl, F, Br, углероды. Они столь же инертны, имеют время жизни в тропосфере примерно 70 лет и могут проникать в стратосферу. Под действием УФ-излучения они разлагаются с выделением Br.
![]()
![]()
Эти реакции протекают уже в нижней части стратосферы вблизи тропопаузы, таким образом роль атома Br особенно велика в этом слое. Br действует аналогично Cl, разрушая озон в «бромном» цикле, но существенно активнее Cl – один атом Br может разрушить до 100 тыс. молекул озона. Это объясняется малыми скоростями реакции атома Br и BrO, приводящих к неактивным «резервуарным» газам.
Обобщая, можно сделать вывод, что разрушение стратосферного озона происходит с участием различных частиц, предшественниками которых являются и природные компоненты и антропогенные загрязнители. При этом отдельные циклы действуют не изолированно, а испытывают взаимное влияние, например, дезактивация ClO по реакции с NO связывает азотные и хлорные циклы.
Тем не менее, главную опасность, по общему мнению, несут ХФУ. Учитывая это, во многих странах законодательно введены ограничения на использование фторхлорметанов. Это же стимулировало работы по замене ХФУ на вещества с близкими потребительскими свойствами, не представляющими опасность для озона.
В качестве таких
заменителей предложены F-Cl углеводороды CHFCl2 (фреон 21),
CHF2Cl (фреон 22) и другие. Их отличие от ФХУ заключается в
возможности разрушения в тропосфере (тропосферный сток) по реакции с ОН (на
примере фреона 22): ![]()
Существование такого стока значительно уменьшает их время жизни в тропосфере и делает их менее опасными для стратосферы. Вместе с тем, тропосферный сток фреонов-заменителей зависит от концентрации ОН, который участвует в реакциях с у/в и с СО. Поэтому увеличение поступления у/в и СО в атмосферу в результате антропогенной деятельности может привести снижению скорости разложения фреонов.
Еще одна проблема разложения F, Cl-углеводородов - образование токсичных веществ в ходе превращения радикалов, образующихся по реакции фреонов с ОН, например:
а) при взаимодействии с молекулярным кислородом
![]() -
образование пероксидного радикала
-
образование пероксидного радикала
б) его взаимодействие с NO
![]()
в) образование дифторфосгена – чрезвычайно токсичный и опасный для всех живых организмов, поэтому замена ХФУ F,Cl углеводороды в общем-то не устраняет совсем угрозы озонового слоя и порождает новую экологическую проблему.
![]() О=СF2
О=СF2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.