Концентрация озона в е.Д. соответствует толщине (высоте) слоя озона, который мог бы образовать весь озон, содержащийся в столбе атмосферы единичной площади при неизменных условиях.
За 1 е.Д. принимают слой озона высотой 10-5м (0,01 мм). Общее количество озона в атмосфере меняется от 220 до 760 е.Д. (наиболее часто 200-400 е.Д.) при среднем для всего земного шара значении 290 е.Д.
Общее содержание озона над конкретно территорией изменяется в достаточно широких пределах и зависит не только от фотохимических процессов в атмосфере, но и движения воздушных масс. Есть ряд общих закономерностей изменения концентрации озона, связанных со временем года и географической широтой местности. Не вдаваясь в детали можно отметить, что наибольшие изменения концентрации характерны для высоких широт северного полушария (70-800 с.ш.), где среднее содержание озона меняется от 450 е.Д. в марте (конец зимы начало весны) до 280 в сентябре (т.е. min – осенью). В средних (40-450 с.ш.) широтах изменения меньше (от 370 е.Д. весной до 280 е.Д. осенью) В низких широтах (<300 с.ш.) сезонные колебания практически отсутствуют (< 20 е.Д.).
В южном полушарии картина та же, но менее выраженная.
Озон образуется при взаимодействии атом О(3р) с молекулой О2
![]() [атомарный
О(1Д), взаимодействую с О2 дает
[атомарный
О(1Д), взаимодействую с О2 дает ![]() со
слишком высокой внутренней энергией, так что молекулу
со
слишком высокой внутренней энергией, так что молекулу ![]() невозможно
стабилизировать при участии 3-ей молекулы]
невозможно
стабилизировать при участии 3-ей молекулы]
Молекула озона при этом
находится в колебательно-возбужденном состоянии и может достаточно легко
распадаться на исходные компоненты. Образование стабильной молекулы О3 происходит
лишь в результате реакции ![]() с молекулой О2
или N2, принимающих избыток энергии, и
последующего теплового рассеивания энергии возбуждения
с молекулой О2
или N2, принимающих избыток энергии, и
последующего теплового рассеивания энергии возбуждения
![]()
С понижением высоты скорость образования озона определяется двумя факторами:
1) повышением концентрации О2 и N2 (что повышает скорость) и
2) уменьшением интенсивности излучения с l<240 нм (вызывающего образование атомарного кислорода) – (что снижает скорость)
Сочетание этих двух процессов определяет наличие максимального содержания озона на высоте около 25 км над экватором озон в стратосфере может распадаться:
· взаимодействуя с атомарным кислородом О(3р) он превращается в молекулярный кислород
![]() (в
основном состоянии)
(в
основном состоянии)
Или подвергаясь фотодиссоциации в результате поглощения коротковолнового УФ излучения (он сильно поглощает УФ излучение в области 220-310 нм, с max – 255 нм)
![]() (либо
О(3р) в зависимости от энергии поглощенного кванта)
(либо
О(3р) в зависимости от энергии поглощенного кванта)
Это важнейший процесс в стратосфере, непосредственно связанный с сохранением жизни на суше (обеспечивающий защиту от УФ излучения).
Эти реакции не приводят к исчезновению озона, поскольку образующийся атомарный кислород О(1Д) (если он образовался при фотодиссоциации) быстро переходит в основное состояние (по рассмотренным реакциям) и вновь участвует в образовании озона. Суммарный процесс образования и разложения озона по приведенным реакциям называется циклом Чепмена:
![]() -
не разделяем на О(1Д) и О(3р)
– лимитирующая стадия синтеза О3
-
не разделяем на О(1Д) и О(3р)
– лимитирующая стадия синтеза О3
![]() (´2 для каждого атома кислорода,
(´2 для каждого атома кислорода,
образовавшегося по
реакции (1) и
вызывающих данную
реакцию)
![]()
![]() -
лимитирующая стадия разрушения озона
-
лимитирующая стадия разрушения озона
Сумма этих реакция
приводит к нулевому циклу – в нем состав систем не меняется, а поддерживается
ее определенное стационарное состояние, причем солнечное излучение УФ-диапазона
преобразуется в тепловое: ![]() .
.
Озоновый цикл ответственен за повышение температуры в стратосфере.
Таким образом в стратосфере естественным путем поддерживается стабильная концентрация О3 вследствие динамического равновесия между процессами образования и разложения.
Как отмечалось совокупность процессов образования и разрушения озона, составляющие цикл Чепмена, определяют некоторую среднюю равновесную концентрацию О3 в стратосфере. Однако, прямые измерения концентрации О3 дают значения меньше предсказываемых теорией Чепмена. Причиной этого является присутствие в атмосфере катализаторов разрушения озона, действие которых дополняет реакции цикла Чепмена, приводящие к разрушению озона.
Каталитические циклы разрушения стратосферного озона
Наиболее важными из катализаторов разрушение озона:
· Гидроксильный радикал ОН – наиболее распространенная частица в атмосфере, вызывающая множество разнообразных реакций
· Монооксид азота
· Атомарный хлор
Разрушение озона при участии этих катализаторов происходит следующим образом:
1) Гидроксильный радикал
![]()
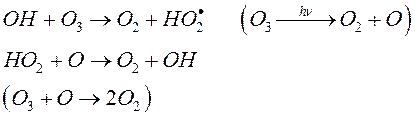
Цикл может разрушиться в результате гибели (рекомбинации) радикалов:
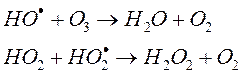
Но до гибели ОН упевает разрушить до 100 молекул О3
2) Монооксид азота
![]()
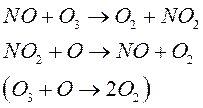
3) Атомарный хлор
![]()
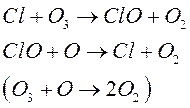
Каждый из катализаторов [в цикле ] регенерируется и вновь вступает в реакции, т.е. развивается циклический процесс, когда 1 частица разрушает большое число молекул О3
ОН, NO, Cl в атмосфере могут появится в результате естественных процессов и в результате антропогенных загрязнений.
Гидроксильный радикал. Их источником являются в основном природные процессы. ОН-радикал
а) является продуктом фотодиссоциации воды
![]()
Но этот процесс происходит только в верхних слоях атмосферы, т.к. требуется коротковолновое излучение
б) образуется (как отмечалось) при взаимодействии атомарного O находящегося в возбужденном О(1d), который выделяется при фотолизе О2 в верхних слоях стратосферы при фотолизе О3:
![]() это гораздо более значимый процесс
это гораздо более значимый процесс
в) к образованию ОН приводит еще ряд стратосферных процессов, вносящих несколько меньший вклад:
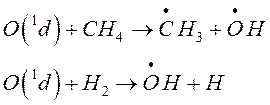
Оксид азота NO
Источники NO в стратосфере преимущественно природные. Главным источником NO считается проникающий в атмосферу оксид N2O. Закись азота образуется на уровне Земли. Она выделяется в атмосферу:
· В результате микробиологической активности в почвах
· При горении биомассы
· При сжигании ископаемого и моторного топлива (в результате высокотемпературного окисления N2 воздуха)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.