n1 и n2- целые числа, причем n1 > n2;
RН - постоянная Ридберга, численное эмпирическое значение которой для водорода равно 109677,76 см-1.
Значение n2= 1 соответствует серии Лаймана, n2=2-серии Бальмера, n2= 3 - серии Пашена и т. д.
Радиусы разрешенных стационарных электронных орбит определяются уравнением
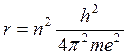 , где п -
главное квантовые числа;
, где п -
главное квантовые числа;
h- постоянная Планка;
т - масса электрона;
е - заряд электрона.
Вычисленный из этого выражения радиус наименьшей орбиты для водорода (при п = 1) равен 0,0529 нм (так называемый боровский радиус). Чтобы вывести электроны, находящиеся на самом глубоком уровне, за пределы атома водорода (п = ∞), т. е. осуществить ионизацию, необходима энергия V = 13,595· ·1,60·10-19дж (V = 13,595 эв). Эта величина известна под названием ионизационного потенциала водорода. При меньших значениях прилаженной энергии электрон не отрывается, а перескакивает на более высокий энергетический уровень и атом переходит в возбужденное состояние. Спектр дейтерия аналогичен спектру водорода с той разницей, что все линии несколько сдвинуты в сторону длинноволновой части спектра из-за большой атомной массы дейтерия и соответствующего изменения значения постоянной Ридберга, зависящей от массы ядра атома.
Существуют две модификации молекулярного водорода: ортоводород и параводород. Различие между ними состоит в там, что в молекулах ортоводорода вращение ядер атомовпроисходит в одинаковых направлениях (параллельные ядерные спины), а в молекулах параводорода - в противоположных направлениях (антипараллельные ядерные спины). При обычных и повышенных температурах количество ортоводорода в газе составляет ~75% (соответственно параводорода ~25%). При низких температурах содержание пapaвoдopодa увеличивается и при -2530С достигает 99,7%. Переход молекул водорода из одной модификации в другую пара-, ортоконверсия) при обычных температурах идет весьма медленно. При термической диссоциации водорода начиная от 700--8000 С и выше пара-, ортопревращение происходит в результате простых столкновений между атомами водорода и недиссоциированными молекулами. Пара-, ортопревращение свойственна также изотопам водорода - дейтерию и тритию, причем в случае трития превращение осуществляется легче и максимальное содержание ортомодификации достигается уже при ~ 1750К.
Диссоциация молекулы водорода, а также ионизация и возбуждение атома водорода могут быть достигнуты как термическим путем, когда причиной ионизации являются соударения быстрых атомов (или молекул), так и при помощи электронного, протонного или ионного удара, т. е. бомбардировкой частицами. Уиттьер анализировал прохождение пучка протонов с энергией ~ (4-7) ·1,60· 10-16 дж (4-7 кэв) через обменную камеру, наполненную водородом, который затем исследовали магнитным методом в смежной камере наблюдения. Было найдено, что при взаимодействии протонов с молекулами водорода в этих условиях образуются нейтральные атомы водорода, быстрые отрицательные ионы Н-, а также ряд молекулярных ионов.
Термодинамические функции для Н±, Н+, Н- и Н2, вычисленные в интервале температур от 293,15 до 200000 К, приводятся В справочной литературе.
При взаимодействии водорода с металлом имеет место диссоциация молекул водорода на атомы и ионизация последних.
Экспериментально установлено существование в металлах в одних случаях положительных ионов водорода (протонов), в других случаях - отрицательных ионов водорода.
Не исключено, что при взаимодействии водорода с металлами образуются также в различной степени возбужденные атомы водорода и молекулярные ионы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.