При повышенных температурах небольшие количества атомарного водорода можно обнаружить специальными методами; в условиях электрической дуги или электрического разряда в газообразном водороде присутствуют уже заметные количества атомарного водорода. Один из наиболее распространенных способов получения атомарного водорода заключается в том, что молекулярный водород подают под давлением в несколько десятых миллиметра ртутного столба в разрядную трубку, к электродам которой приложено напряжение в несколько тысяч вольт. В разрядной трубке происходит диссоциация молекул водорода на атомы. Для увеличения выхода атомарного водорода в качестве исходного продукта применяют влажный водород, так как адсорбирующаяся на стенках трубки влага препятствует рекомбинации атомов водорода. Получаемый продукт, содержащий обычно 40-50% атомарного водорода, эвакуируется посредством вакуумной системы.
Электронейтральный атом водорода представляет собой простейшую атомную систему. Известны три изотопа водорода. Наиболее распространен легкий стабильный изотоп - протий. Его атом состоит из одного протона и одного электрона. Второй стабильный изотоп водорода - дейтерий, или тяжелый водород. Его массовое число равно 2. Ядро дейтерия, называемое дейтероном или дейтоном, состоит из одного протона и одного нейтрона, а электронная оболочка - из одного электрона. В обычном природном водороде содержится 0,0149% дейтерия (99,9851 % протия). Дейтерий образует тяжелую воду D20.
Дейтерий играет большую роль в современной физике и химии. Он замещает легкий водород в различных соединениях; ядро дейтерия является одним из наиболее удобных снарядов, применяемых для расщепления ядер.
Третий изотоп водорода – тритий имеющий массовое число 3, обладает радиоактивностью с мягким излучением. Основной причиной появления его в атмосфере земли является – воздействие нейтронов космических лучей. Известно, что на 1018 атомов водорода приходится от 0,5 до 67 атомов трития. Такое количество трития соответствует скорости его образования под влиянием космических лучей (≈ 0,12 атомов· см-2 • сек-1), если исходить из того, что скорость образования трития равна скорости его переноса в океаны атмосферными осадками и водами рек. Запас трития на земле равен 1800 г. В настоящее время тритий не имеет практического применения, имеются лишь указания о возможности использования природного трития в качестве «меченого атома» при исследовании ряда метеорологических процессов. Период полураспада трития равен 12,262 года.
Спектр атомарного водорода имеет линейчатый характер и состоит из нескольких серий, каждая из которых содержит ряд линий, возникающих при переходах электрона с более удаленных орбит на орбиту с меньшим главным квантовым числом. На рис. 1 приведена схема энергетических уровней атома водорода, иллюстрирующая возникновение серий линий водородного спектра. Серия Лаймана включает спектральные линии, возникающие при переходах электрона со стационарных орбит с квантовыми числами п, равными последовательно 2, 3, 4, 5 и 6, на орбиту с квантовым числом п = 1. Переходам электрона с более удаленных орбит на стационарную орбиту с квантовым числом п = 2 соответствуют линии серии Бальмера, которые обычно обозначаются как Нα, Hβ, Нγ, и Нδ.Так же возникают и другие серии линий спектра водорода. Расположение линий водородного спектра подчиняется строгай закономерности,
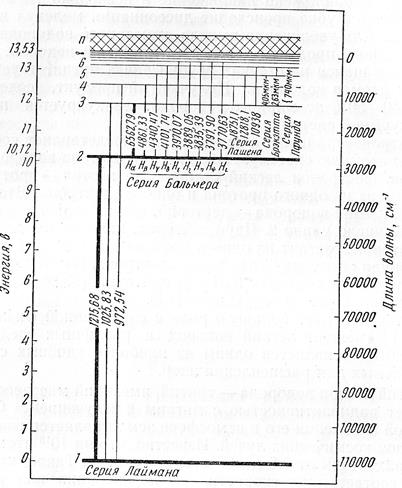
Рис. 1. Схема энергетических уровней атома водорода длины волн линий серий Лаймана, Бальмера и Пашена даны в с.м-8
выражающейся общим уравнением
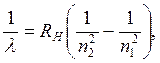
где λ - длина валны спектральной линии, см;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.