Соединения висмута получают из металла марки Ви1 (не менее 98% Bi) путем растворения его гранул в азотной кислоте с концентрацией 7-9моль/л. При этом порядка 50% кислоты выделяется в газовую фазу в виде токсичных оксидов азота, а процесс растворения может быть описан уравнением:
Bi + 6НNОз = Вi(NОз)з+ 3NO2↑ + ЗН2O (4.1)
Однако целесообразнее проводить предварительное окисление металлического висмута до оксида кислородом воздуха и введением в его расплав 20-30% оксида висмута при (350±50)0С, при перемешивании удается осуществлять диспергирование металла и получать агломераты размером не более 3 мм. В результате операции диспергирования реакционная поверхность металлического висмута увеличивается и соответственно повышается его способность к окислению:
4Bi + 3О2 = 2ВiО3 (4.2)
При получении соединений висмута из металла предварительный перевод его в оксид позволяет получать концентрированные растворы различных солей висмута. При использовании азотной кислоты удается, по сравнению с реакцией (1), сократить ее расход, устранить выделение в атмосферу токсичных оксидов азота и получать концентрированный раствор нитрата висмута, процесс растворения протекает по уравнению:
Вi2О3 + 6HNO3 = 2Bi(NO3)3 + ЗН2О. (4.3)
Очистку висмута от примесных металлов осуществляют обычно на стадии гидролиза при добавлении к раствору нитрата висмута раствора щелочного реагента. При осаждении висмута из нитратных растворов добавлением щелочных реагентов (водного раствора аммиака, едкого натра, карбонатов натрия или аммония) степень извлечения висмута в осадок существенно зависит от рН среды. Увеличение рН раствора до 0,8-1,0 позволяет достичь практически полного осаждения висмута (остаточная концентрация Bi в растворе 5-2 г.л-1). Гидролиз раствора нитрата висмута проходит по реакции:
6Bi(NO3)3 + HNO3 +14NaOH = [Bi6O5(OH)3](NO3)5.3H2O↓ (4.4)
+ 14NaNO3 + 3 H2O
Получение гидроксохромата висмута производится взаимодействием тригидрата нитрата оксогидроксовисмута (III) состава [Bi6O5(OH)3](NO3)5.3H2O (содержание висмута 72,28 % и нитрат-ионов 17,38 %) и водного раствора дихромата калия, проведенного при температуре (23±1) 0С и при начальной концентрации азотной кислоты в растворе, равной 0,85 моль/л, по реакции:
[Bi6O5(OH)3](NO3)5.3H2O +3 K2Cr2O7 + HNO3 = 6BiOHCrO4↓ (4.5)
+ 6KNO3 + 2H2O
В целом процесс получения гидроксохромата висмута протекает по следующей принципиальной функциональной схеме (рис. 4.1):
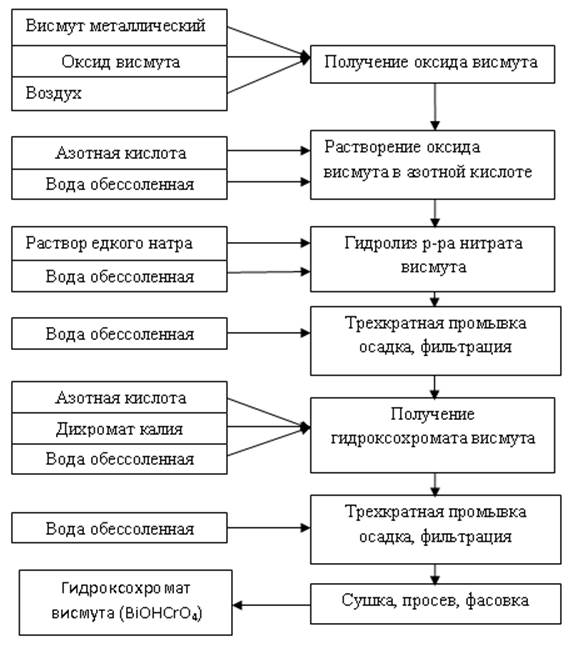
Рисунок 4.1 – Функциональная схема получения гидроксохромата висмута
Технологическая схема (рис. 4.2) включает следующие стадии: получение оксида висмута окислением кислородом воздуха, растворение полученного оксида в азотной кислоте, гидролитическую очистку висмута от сопутствующих металлов при его осаждении в виде тригидрата нитрата оксогидроксовисмута (III), фильтрацию и сушку продукта. В работе используется металлический висмут марки Ви 1, содержащий (в мас.%): висмута – 98,3; свинца – 1,43; серебра – 5,6×10-2; меди – 9,5×10-3; железа – 6,2×10-3; цинка – 6,4×10-4; олова – 1,0×10-3; сурьмы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.