изомеризации алканов, что приводит к недостаточной эффективности процесса изомеризации гексана на катализаторах, не содержащих галогены. Решением данной проблемы является увеличение концентрации льюисовских кислотных центров. В настоящее время разработан катализатор скелетной изомеризации н-гексана Pt/SO42-/Al2O3/ZrO2 с концентрацией льюисовских кислотных центров 200-250 мкмоль/г.
Гидроксиды циркония и алюминия осаждают из водных растворов азотнокислых солей аммиаком при pH 7-11,5. Полученные твердые частицы промывают дистиллированной водой до удаления нитрат-ионов. Совместный гидроксид циркония-алюминия сульфируют H2SO4 и прокаливают при температуре 650ºС. Платину вводят путем нанесения по влагоемкости платинохлористоводородной кислоты. Высушенный образец прокаливают при температуре не выше 500ºС, таблетируют и измельчают. Содержание сульфата SO4 в катализаторе составляет 3,0-9,0 мас.%, оксида алюминия Al2O3 2,5-3,0 мас.%, платины Pt 0,3-0,6 мас.%, оксида циркония ZrO2 87,5-94,2 мас.%. Поверхность полученных образцов составляет 100-120 м2/г.
Катализатор изучают в реакторе непрерывного действия с неподвижным слоем катализатора с хроматографическим анализом on line. Реакцию проводили в следующих интервалах изменения параметров: соотношение H2/C6H14 от 2:1 до 5:1, давление от 0,3 до 1,5 МПа, температура от 180ºС до 250ºС.
Изучение кинетики изомеризации н-гексана на твердых суперкислотах показало, что процесс можно разделить на три стадии. Первая и самая быстрая стадия, идущая до термодинамического равновесия, – образование 3-метилпентана (3MP) из 2-метилпентана (2MP), потом 2,3-диметилбутана (2,3 DMP). Скорости реакций изомеризации н-гексана и образования 2,2-диметилбутана (2,2 DMP) сравнимы. Третья стадия – образование побочных продуктов. Похожие результаты при изомеризации н-гексана были получены на катализаторе HF-SbF5.
Для анализа кинетики была использована следующая схема реакций:
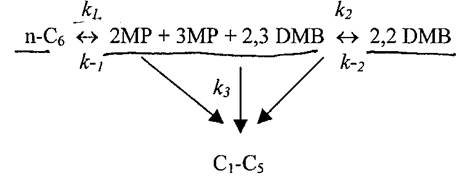
Скорость изомеризации зависит от многих факторов: соотношения реагентов, продолжительности реакции и др. Однако не вызывает сомнений, что реакция идет по первому порядку по каждому реагенту.
Расчет констант скоростей, характеризующих активность и селективность катализатора, проводился по математической модели реактора с пульсирующим потоком:
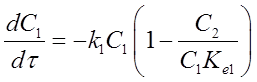 ,
,
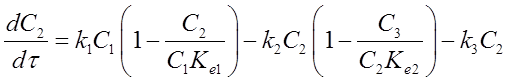 ,
,
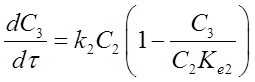 ,
,
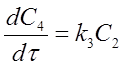 , где С1 – мольная доля н-гексана, С2
– мольная доля 2 MP + 3 MP
+ 2,3 DMP, С3 -
мольная доля 2,2 DMP, С4
– мольная доля продуктов крекинга, τ – время контакта, ki,k-i
–
константы скорости прямых и обратных реакций изомеризации н-гексана и
образования 2,2 DMB, Kei
– константы равновесия.
, где С1 – мольная доля н-гексана, С2
– мольная доля 2 MP + 3 MP
+ 2,3 DMP, С3 -
мольная доля 2,2 DMP, С4
– мольная доля продуктов крекинга, τ – время контакта, ki,k-i
–
константы скорости прямых и обратных реакций изомеризации н-гексана и
образования 2,2 DMB, Kei
– константы равновесия.
Для решения системы дифференциальных уравнений, которая описывает баланс компонентов в газовой фазе, мы использовали полунеявный метод Рунге-Кутта для интегрирования множества жестких обыкновенных дифференциальных уравнений.
Подсчет кинетических констант скоростей делался в следующем порядке:
1) Термодинамическое равновесие было рассчитано на основе значений энтальпий и энтропий образования н-гексана, 2MP, 3MP, 2,3 DMP, 2,2 DMP и равновесные концентрации каждого из упоминаемых компонентов были получены для каждой температуры из интервала 150-250ºС (рис. 1).
2) Константы равновесия для всех стадий из схемы 1 были рассчитаны на основе равновесных концентраций.
3) Константы скорости были рассчитаны на основе отчетных экспериментальных данных и констант равновесия.
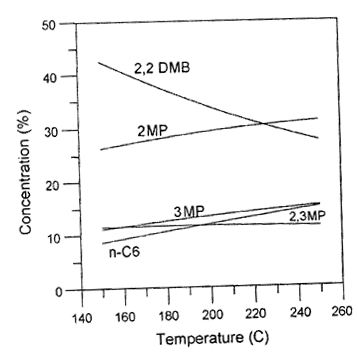
Рис. 1. Зависимость равновесных концентраций продуктов изомеризации н-гексана от температуры.
Кинетические константы скорости и энергии активации были рассчитаны. Рисунки 2 и 3 представляют экспериментальные и расчетные
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.