Мякишев (10кл) стр. 139-223 (Физика, М. «Просвещение» 2004.)
<МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА>
Ставится основная задача: изучить свойства макроскопических тел и тепловые процессы с учетом того, что тела состоят из отдельных беспорядочно движущихся частиц на основе законов , описывающих особый вид материи – тепловое движение. В какой-то степени тепловые явления – это механика микромира.
При этом целесообразно использовать положения, установленные в механике, и поэтому нужно начать рассмотрение теплового движения не с описательного, а с обобщенно-энергетического уровня.
1< ОСНОВЫ МКТ > Вещества состоят из атомов и молекул, находящихся в беспорядочном движении и взаимодействующих между собой; молекулы слишком малы (их масса 1,7·10-27 ÷ 4,4·10-25 кг), чтобы применить положения механики , разработанные для макротел вводят следующие основные понятия Относительная молекулярная масса
μг = mo / (1/12 ×moc ) где moc - масса атома углерода ; Число АвогадроNA = 6·1023 – это число молекул содержащееся в 0,012кг углерода (или в одном грамме водорода) ; Количество вещества - υ = N/NA [ моль], где N - количество молекул данного вещества ; Молярная масса μ =moNA [кг/моль]- вес одного моля данного вещества, тогда υ = m / μ , где m - масса данного вещества [кг]. Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежительно мало. Молекул много и скорости их различны, поэтому используют среднестатистическую картину.
Далее, используя положения механики, определим количественные характеристики идеального газа. В любом объеме идеального газа ( V ) с концентрацией n = N / V

 Ux скорость молекул U2 = Ux2 + Uy2 +Uz2 . За
1с о стенку y
Ux скорость молекул U2 = Ux2 + Uy2 +Uz2 . За
1с о стенку y
m площадью S ударяется (½ nUxS) молекул, тогда суммар- Ux2 = 1/3 U2
- Ux ный импульс за 1с (2mo Ux)∙(1/2 nUxS) = F·1с. Так как из x
импульс механики импульс в единицу времени равен по z
2m0 Ux величине силе, то находим давление
Ux2 = 1/3U2 P = 1/3rU2
![]()
![]() на стенку Р = F/S
P=1/3
monU2P =
2/3 nE .
на стенку Р = F/S
P=1/3
monU2P =
2/3 nE .
mon = r = m/V E = moU2/2
Полученное основное уравнение МКТ раскрывает суть связи, Но! на практике использовать ее сложно из-за трудностей в измерениях величин E и U. Учитывая, что E и toCвзаимосвязаны однозначно, а toС – легко измеряется, попробуем заменить Е на
2<ТЕМПЕРАТУРУ > Эксперимент показал, что при любой одной и той же температуре для разных газов 2/3E = P/n = P1V1 / N1 = P2V2 /N2 =…= PnVn /Nn = const = q ← назовем эту величину естественной температурой ( q [Дж]) при этом
qльда = РV/N = 3,76 10-21 Дж. qкипятка = 5,14-21Дж
Ранее используемое понятие температура tº C не соответствует полученному понятию, а значит, физической сущности, т.к. qльда = 0. Чтобы перейти к физически обоснованному понятию, оставив термин “температура” и единицу измерения “градус” надо за “0”принять t при Е=0. Обозначим ее Тº К (температура в градусах Кельвина). Тогда q = kТ , k – постоянная Больцмана позволяет осуществить переход от q [Дж] к Тº К,
тогдаk =( 5,14×10-21 – 3,76×10-21 ) / (Ткипятка – Тльда )= 1,38×10-23 (Дж/ºК).
Тогда : Тльда = qльда /k = 273ºК Þ ТºК = (tºС + 273)ºК;
q = kТ = 2/3Е Þ Р = nkТ = (N/V)×kТ = (m/moV)×kТ ;
Энергия молекулы газа : mo U2 / 2 = Е = 3/2 kТ ÞU = Ö 3kТ/mo так как mV2/2=3/2kT, T – мера количественная среднестатистической энергии поступательного движения молекул. Р = nkТ
Уравнение Р = nkТ применить пока сложно, так как остается проблема измерения на практике величины n поэтому было установлено
3 <УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА >
P = nkT = (N/V) kT = (mNA /mV) kTÞkNA = R ; R = 8.31Дж/моль К Þ
![]()
![]()
PV = (m/m)RT- уравнение Менделеева. P=ρ/μвRT – для атмосферного воздуха.
R – универсальная газовая постоянная.
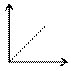
Рассмотрим частные случаи / изопроцессы/
![]()
![]()
 V1/T1=V2/T2 V P1/T1=P2/T2
P P1V1=P2V2
P
V1/T1=V2/T2 V P1/T1=P2/T2
P P1V1=P2V2
P
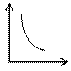 V = (mR/Pm)T P =
(mR/Vm)T P
=(mRT/m) 1/V
V = (mR/Pm)T P =
(mR/Vm)T P
=(mRT/m) 1/V
Теперь вместо уравнения Р = (2/3 )nE получено уравнение Р = (mRT) / (mV) , в котором физические величины определяются с помощью термометра, манометра, линейки и весов, а значит, его можно эффективно использовать на практике для количественного анализа реальных процессов в газах. Но ! в природе газы почти всегда находятся в смеси и самая распространенная смесь – это воздух. Рассмотрим один из важнейших компонентов воздуха – пары воды (влажность воздуха).
4<ОТНОСИТЕЛЬНАЯ ВЛАЖНОСТЬ ВОЗДУХА> Пар, находящийся в динамическом равновесии со своею жидкостью, называют насыщенным паром. Его давление Ро = nнkT. Давление, которое производил бы газ при отсутствии всех остальных газов, называют парциональным. (Если газов несколько, то суммарное давление – есть сумма парциональных давлений (определена законом Дальтона) Р = Р01 + Р02 + …+ Р0n ). Нормальные условия t= 0 ˚C; P=101325 Па.
 Относительная
влажность воздуха j = (P / Pн) 100%, где
Р - парциальное давление ненасыщенного пара при данной температуре. Для
измерения j используют психрометр –
два термометра (сухой и влажный), по разности показаний (∆Т)
определяется j. Если
нагревать воду в закрытом сосуде, то получим зависимость Р от Т. (плотность от
температуры) tk– критическая
температура, при
которой исчезают различия между жидкостью и паром.
Относительная
влажность воздуха j = (P / Pн) 100%, где
Р - парциальное давление ненасыщенного пара при данной температуре. Для
измерения j используют психрометр –
два термометра (сухой и влажный), по разности показаний (∆Т)
определяется j. Если
нагревать воду в закрытом сосуде, то получим зависимость Р от Т. (плотность от
температуры) tk– критическая
температура, при
которой исчезают различия между жидкостью и паром.
5<ТЕРМОДИНАМИКА> Возникла раньше МКТ и ставила задачу получения оптимальных условий использования теплоты для совершения работы, изучает те же явления, что и МКТ, Но ! имеет более описательный характер и опирается на два закона термодинамики
Первый закон (закон Сохранения) ∆U = A + Q, где ∆U - изменение внутренней энергии системы ; Q- теплота переданная системе ; A– работа внешних сил. Из этого следует, что в замкнутой системе внутренняя энергия = const. При определении Q используют понятия: теплоемкость «С» [ Дж/кг град] , удельная теплота плавления l - [Дж/кг], удельная теплота парообразования r – [Дж/кг], H-[Дж/кг] – теплота сгорания.
Второй закон термодинамики : Невозможно перевести теплоту от более холодного к более горячему телу без совершения работы извне.
Внутренняя энергия N молекул одноатомного идеального газа U = NE = N 3/2kT = 3/2 (m/µ)RT Þ ∆U= 3/2 (m /m) R∆T. Работа, которую совершает тепловой двигатель А` равна работе, совершаемой газом А` : А` = - А = -р ∆V. р – давление, ∆V - изменение объема.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.