Цель работы: усвоить одно из основных химических понятий- понятие об эквиваленте- и научиться определять его количественное значение.
Общие сведения.
Эквивалентной массой вещества называется такое его количество, которое соединяется с одним молем атомов водорода, замещает то же количество атомов водорода в химических реакциях или реагирует без остатка с одним эквивалентом любого другого вещества.
Один из основных законов химии гласит: “Массы веществ, вступивших в реакцию, пропорциональны их химическим эквивалентам”.
При проведении расчетов обычно
эквиваленты вычисляют по формуле:![]() , где М- молярная масса
вещества, z- число эквивалентов в моле.
, где М- молярная масса
вещества, z- число эквивалентов в моле.
Эквивалентным объемом называют объем, занимаемый при данных условиях эквивалентной массой вещества.
Схема экспериментальной установки.
|
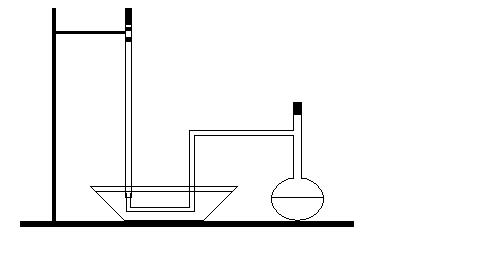
Порядок выполнения работы:
1) наполнить водой бюретку и закрепить её в штативе;
2) закрыв верхнее отверстие бюретки, перевернуть её и опустить в чашу с водой;
3) в колбу Вюрца налить 15-20 мл соляной кислоты и вытереть насухо горло колбы фильтром;
4) расположив колбу горизонтально, поместить в её горло навеску металла, закрыть колбу пробкой;
5) вставить присоединенную к боковому отводу колбы резиновую трубку в опущенный в воду конец бюретки;
6) отметить уровень жидкости в бюретке;
7) перевернув колбу в вертикальное положение, сбросить навеску металла в кислоту;
8) когда выделится весь водород, ещё раз отметить уровень воды;
9) миллиметровой линейкой измерить высоту столба воды в бюретке над уровнем воды в чашке.
Порядок вычислений.
1) записать атмосферное давление и температуру в лаборатории;
2) записать массу навески металла;
3) рассчитать давление водорода в бюретке:
![]() , где
, где ![]() - атмосферное давление в лаборатории,
Па;
- атмосферное давление в лаборатории,
Па; ![]() - давление столба воды в бюретке, Па;
- давление столба воды в бюретке, Па;
![]() - давление насыщенного водяного пара,
Па ( находим его по таблице);
- давление насыщенного водяного пара,
Па ( находим его по таблице);
4) вычислить
массу выделившегося водорода: ![]()
![]() , где:
, где: ![]() -
молярная масса водорода;
-
молярная масса водорода; ![]() - объем водорода,
- объем водорода,![]() ;
; ![]() -
универсальная газовая постоянная. Найти эквивалент металла по закону
эквивалентов:
-
универсальная газовая постоянная. Найти эквивалент металла по закону
эквивалентов: ![]() , где
, где ![]() =1- эквивалент водорода. По заданной
степени окисления металла определить его молекулярную массу и провести его
идентификацию.
=1- эквивалент водорода. По заданной
степени окисления металла определить его молекулярную массу и провести его
идентификацию.
5) Вычислить
точное значение эквивалента металла: ![]() , где z- степень окисления металла,
, где z- степень окисления металла, ![]() -
молярная масса металла(по таблице Д.И. Менделеева);
-
молярная масса металла(по таблице Д.И. Менделеева);
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.