2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Определение жесткости воды
Реактивы.
1.Аммиачный буферный раствор, pH 10
2. Трилон Б, 0,05 н раствор
3.Соляная кислота, 0,1 н раствор
4.Гидроксид натрия, 1 н раствор
5.Индикатор эриохром черный Т
6.Индикатор мурексид
Общая жесткость
В коническую колбу на 250 мл вносили 100 мл анализируемой воды, добавляли 5 мл аммиачного буферного раствора (pH 10), 0,1-0,2 г индикатора эрнохрома черного Т (на кончике шпателя) и оттитровывали 0,05 н раствором трилона Б до перехода винно-красной окраски раствора в сине-зеленую.
Титрование прошло медленно при интенсивном перемешивании.
Общая жесткость воды
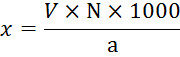
Где V – количество трилона Б, пошедшее на титрование , мл
N – нормальность трилона Б, мг-экв/k
a – объем воды, взятой для анализа, мл
Кальциевая и магниевая жесткость
В коническую колбу на 250 мл вносили 100 мл анализируемой воды, 2 мл 0,1 н НСl и кипятили в течении 5 мин для удаления углекислого газа. Затем раствор охлаждали до комнатной температуры и добавляли 2 мл 1 н раствора NaOH и 0,1 - 0,2 г индикатора мурексида (на кончике шпателя). Содержимое колбы оттитровывали 0,1 н раствором трилона Б до перехода розовой окраски в лиловую.
Кальциевая и магниевая жесткость (в мг-экв/л) рассчитывается по формуле:
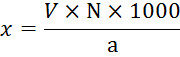
Где V – количество трилона Б, пошедшее на титрование , мл
N – нормальность трилона Б, мг-экв/k
a – объем воды, взятой для анализа, мл содержание ионов магния (магниевая жесткость) вычисляют по разности между общей и кальциевой жесткостю:
ЖMg=Жo-ЖCa
2.2. Определение щелочности воды
Реактивы:
1.Соляная кислота, 0,1 н раствор
2.Индикатор фенолфталеин
3.Индикатор метиловый оранжевый
Предварительно
определили реакцию анализируемой воды по изменению окраски при добавлении к ней
индикаторов: метиловому оранжевому, изменяющему окраску при pH 3,6, и по
фенолфталеину, изменяющему при pH 8,3. Реакцию воды определяют присутствие в
ней ионов ![]() или
или ![]() ,
,![]() ,обусловливающих ту или иную
величину pH.
,обусловливающих ту или иную
величину pH.
В пробирку с исследуемой водой добавили 3 - 5 капель индикатора и, наблюдая за окраской, отмечают один из возможных вариантов:
|
Реакция воды при внесении: |
Наличие в испытуемой воде ионов: |
|||||
|
Метилового оранжевого |
Фенолфталеина |
|
|
|
|
|
|
1 |
Вода желтая |
Вода розовая |
+ |
отс |
+ |
|
|
2 |
Вода желтая |
Вода бесцветная |
+ |
|||
|
3 |
Вода оранжевая |
Вода бесцветная |
отс |
+ |
отс |
|
При наличии щелочной реакции испытуемой воды определяют величину щелочности.
В
коническую колбу на 250 мл вносили, 100 мл анализируемой воды, 3 капли
фенолфталеина и оттитровывали 0,1 н раствором соляной кислоты до исчезновения
розовой окраски титруемого раствора (объем ![]() ).
).
Затем
в ту же колбу добавляли 3 капли метилового оранжевого и продолжали титрование
соляной кислотой до перехода желтой окраски раствора в оранжевую (объем ![]() ).
).
Свободная
щелочность (в мг-экв/л) рассчитывается по формуле:
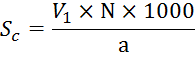
Где
![]() - кол-во HCl,пошедшее
на титрование с фенолфталеином, мл
- кол-во HCl,пошедшее
на титрование с фенолфталеином, мл
N – нормальность раствора соляной кислоты, мг-экв/л
a – объем воды, взятой для анализа, мл
Общая
щелочность (в мг-экв/л) рассчитывается по формуле:
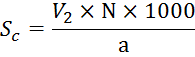
Где
![]() - кол-во HCL,
пошедшего на титрование с метиловым оранжевым, мл
- кол-во HCL,
пошедшего на титрование с метиловым оранжевым, мл
2.3 Фотометрическое определение железа (III) в форме роданида
Оборудование и реактивы:
1. спектрофотометр UNICO (ЯПОНИЯ) 2800 UV/VIS
2. Пипетка 1 см3.
3. Пипетка 5 см3-2 шт.
4. Колба мерная 50 см3
5. Стандартный раствор соли железа(Ш), 0,1 мг/1 cм3
6. Роданид аммония NH4CNS, 10% раствора
7. Азотная кислота HN03 (раствор 1:1)
Выполнение работы:
1. Приготовление раствора сравнения. Мерную колбу емкостью 50 ш наполняли на 2/3 дистиллированной водой, добавляли 1 мл HNO3 (раствор 1:1) и 5 мл раствора NH4CNS.Объем раствора доводили до метки дистиллированной водой и тщательно перемешивали.
2. В 10 мл исследуемой воды вносили 1 мл HNO3 (раствор 1:1) и 5 мл раствора NH4CNS и доводили до метки дистиллированной водой.
3. Определение оптической плотности: в кювету толщинов 1 см внесли раствор из первой колбы (образцовая кювета). В другую кювету такой же толщины внесли раствор сравнения (контрольная кювета). Обе кюветы закрепили в кюветном отсеке. Выбрали синий светофильтр (400нм) и при прохождении света через контрольную кювету, регулировочными ручками «грубо» и «тонко» установили стрелку измерительного прибора на «0» по нижней (логарифмической) шкале измерения оптической плотности. Не открывая кюветного отсека, ручкой переводят образцовую кювету в положение, при котором свет проходит через нее. Показания стрелки на измерительном приборе по нижней шкале дало значение оптической плотности (А). Последовательно сделали оптическую плотность раствора с исследуемой водой. Оптическую плотность каждого раствора измерели 3-4 раза.
2.4 Кондуктометрическое определение солености воды
Оборудование:
Кондуктометр HANNA instrument Ec 215
Пластиковый стаканчик
Соленость воды определяли по величине электропроводности с использованием калибровочного графика.
С этой целью была приготовлена серия растворов хлорида натрия и построена зависимость электропроводности растворов от концентрации соли.
2.5 Качественное определение сульфат-ионов
Оборудование и реактивы:
1. Пипетка 1 см3.
2. раствор нитрата бария, Ba(NO3)2, 0,1 мг/1 cм3
3. Соляная кислота HN03 (раствор 1:1)
К 2-3 каплям исследуемого раствора, подкисленного 1-2 каплями 2М раствора HCl, добавляли 1-2 капли раствора нитрата бария. Образование белого осадка является показателем присутствия сульфат-ионов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.