В такой постановке задачи вторая стадия, управляемая кинетикой конкурирующих реакций образования и разложения окиси азота, очевидно, будет общей для всех видов азотсодержащих топлив.
Поскольку качественно эффекты подавления выхода окислов азота режимными мероприятиями оказываются одинаковыми при сжигании как жидкого, так и твердого азотсодержащего топлива, есть основания предположить, что определяющей в процессе является вторая стадия. Для описания закономерностей протекания этой стадии на основе результатов предыдущих исследований можно выбрать определяющие кинетику окисления азота топлива реакции:
N+O2=NO+O
N+NO=N2+O
Система кинетических уравнений, описывающих рассматриваемый процесс, представляется в виде
Еще до решения системы уравнений, применяя условие стационарности для NO, поскольку она генерируется в первой реакции и расходуется во второй, можно получить информацию, подтверждающую правомерность предположения об Определяющей роли второй стадии процесса. Полагая dNO/Dj = 0, получаем:
Как видно, стационарное значение концентрации NOCT не зависит от содержания азота в топливе и определяется отношением констант скоростей конкурирующих реакций и концентрацией кислорода. Стационарная концентрация представляет собой предельно-возможное значение выхода окиси азота из азота топлива при данных температуре и концентрации кислорода.
Из выражения (3) можно видеть, что на стационарную концентрацию содержание кислорода оказывает существенно более сильное влияние, чем уровень температуры, поскольку обе константы скорости реакций зависят от температуры.
I ступень
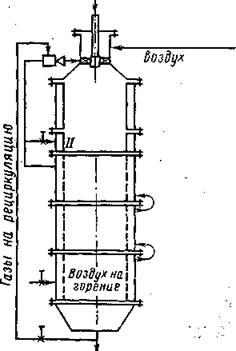
Рис. 2. Принципиальная схема экспериментального стенда
Так, при T= 1500 К изменение а от 1 до 1,4
(рассматривается избыточный кислород) приводит к двадцатикратному увеличению
значения NOст, в то
врем как при увеличении температуры с 1000 до 2000 K значение
возрастает в 6 раз. Таким образом, в диапазоне изменения ![]() и Т, представляющем интерес для практики,
концентрация кислорода оказывает раза более сильное влияние, чем температура,
логичное влияние концентрации кислорода и температуры на переход, азота топлива
в окислы неоднократно обнаруживалось экспериментально.
и Т, представляющем интерес для практики,
концентрация кислорода оказывает раза более сильное влияние, чем температура,
логичное влияние концентрации кислорода и температуры на переход, азота топлива
в окислы неоднократно обнаруживалось экспериментально.
Для дальнейшего приближения кинетической дели к действительному процессу можно в системе кинетических уравнений ввести функции генерации топливного азота, расходования кислорода и изменения температуры по длине факела. Имея в виду относительно слабую зависимость выхода топливных окислов азота от температуры, для решения поста ленной задачи на первом этапе можно ограничить постоянным значением температуры.
Для факела жидкого топлива, содержащего азот| в качестве функции генерации азота можно использовать зависимость выгорания топлива от времени. Основанием для этого может служить тот факт, что дифракционные топлива в процессе выгорания жидкотопливного факела не претерпевают разгонки, выгорают как монофракционные. Исходя из этого функцию генерации азота при горении жидкого топлива можно записать в следующем виде:
N=NT(1-e-jt)
где NT— содержание азота в топливе; j —коэффициент, характеризующий скорость выгоранияс-1 ,t-время выгорания, с.
Функцию расходования кислорода по аналогу можно записать в виде
O2=(O2n-O2k)e-jt+O2k
где О2 и O2k — начальная и конечная концентрации кислорода.
Система кинетических уравнений с введение функции генерации азота и расходования кислорода имет следующий вид:
Начальные условия, при которых решается эта си-ц-ема уравнений следующие: т=0; N=0; NO=0; N2=79% и O2=O2н.
В таком виде модель учитывает и первую стадию процесса — образование активного азота и вторую — изменение средней концентрации кислорода по мере 1горания топлива. В результате решения системы равнений (6), выполненного на ЭВМ, получены расчетные зависимости, приведенные на рис. 1. Как следует из графиков, наибольшее влияние на выход топливной окиси азота оказывает конечная концентрация кислорода. Увеличение конечной концентрации кислорода от нуля до 4% и более, характерных для реальных топочных устройств, приводит при прочих равных условиях к шестикратному возрастанию выхода окиси азота (рис. 1,а).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.