

С. П. Ивонин, А. А. Анищенко, А. С. Пугачёва
Днепропетровский национальный университет
N,N-ДИМЕТИЛГИДРАЗОН ФУРФУРОЛА В РЕАКЦИЯХ
С ЭЛЕКТРОФИЛЬНЫМИ РЕАГЕНТАМИ
Досліджено моно- та біс-фосфорилювання та формілювання N,N-диметилгідразону фурфуролу. Показано можливість отримання різних типів продуктів з електрофільними реагентами.
Investigate of mono- and bis-fosforylation and formylation of N,N-dymethylhidrazone of furfural. Shown ability obtaining several types products with electrophilic agents.
Гидразоны относятся к классу азометинов, однако в них направление поляризации C=N связи принципиально отлично. Благодаря сопряжению НЭП аминного атома азота с кратной C=N связью азометиновый атом углерода в гидразонах является достаточно ярко выраженным нуклеофильным центром. Кроме того, гидразонная группа, вступая в сопряжение с гетероароматическим фрагментом способна оказывать активирующее действие, благодаря чему появляется возможность функционализации последнего.
Фосфорилирование N,N-диметлгидразона фурфурола эквимолекулярным количеством трехбромистого фосфора в бензоле, при температуре 0-+50С происходит практически мгновенно с образованием дибромфосфина 1. (ЯМР 31Р 98,8 м. д.). Эффект активации фуранового цикла гидразонным фрагментом настолько силен, что проведение этой же реакции при 200С приводит к сильному осмолению реакционной смеси. Дибромфосфин 1 действием морфолина был превращен в амид 2, из амида 2 при окислении серой был получен тиоамид 3.

Необходимо отметить, что фосфорилирование N,N-диметилгидразона фурфурола происходит региоселективно в положение 5 фуранового цикла.
Бисфосфорилирование N,N-диметлгидразона фурфурола происходит при добавлении двойного избытка трехбромистого фосфора в пиридине с образованием бис-дибромфосфина 4. В бензоле эта реакция останавливается на стадии дибромфосфина 1 . Тиоамид 3 в пиридине так же фосфорилируется трехбромистым фосфором с образованием дибромфосфина 5. Бис-дибромфосфин 4 и дибромфосфин 5 при добавлении соответствующих количеств морфолина и серы были превращены в бис-тиоамид 6. Структура бис-тиоамида 6 подтверждается ПМР спектром, в котором присутствует синглет 7,15 м. д., соответствующий протону фуранового кольца и синглет 7,90 м. д. группы ( CH=N).

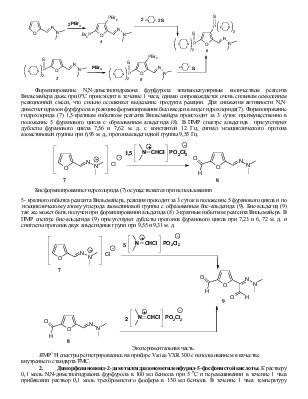
Формилирование N,N-диметилгидразона фурфурола эквимолекулярным количеством реагента Вильсмайера даже при 00С происходит в течение 1 часа, однако сопровождается очень сильным осмолением реакционной смеси, что сильно осложняет выделение продукта реакции. Для снижения активности N,N-диметилгидразон фурфурола в реакцию формилирования был введен в виде гидрохлорида(7). Формилирование гидрохлорида (7) 1,5-кратным избытком реагента Вильсмайера происходит за 3 суток преимущественно в положение 5 фуранового цикла с образованием альдегида (8). В ПМР спектре альдегида присутствуют дублеты фуранового цикла 7,56 и 7,62 м. д. с константой 12 Гц, сигнал экзоциклического протона азометиновой группы при 6,95 м. д., протона альдегидной группы 9,55 Гц.
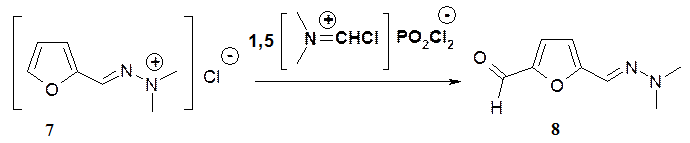
Бисформилирование гидрохлорида (7) осуществляется при использовании
5- кратного избытка реагента Вильсмайера, реакция проходит за 3 суток в положение 5 фуранового цикла и по экзоциклическому атому углерода азометиновой группы с образованием бис-альдегида (9). Бис-альдегид (9) так же может быть получен при формилировании альдегида (8) 2-кратным избытком реагента Вильсмайера. В ПМР спектре бис-альдегида (9) присутствуют дублеты протонов фуранового цикла при 7,23 и 6, 72 м. д. и синглеты протонов двух альдегидных групп при 9,55 и 9,31 м. д.
Экспериментальная часть
ЯМР 1Н спектры регистрировались на приборе Varian VXR 300 с использованием в качестве внутреннего стандарта ТМС.
2. Диморфолиноамид-2-диметилгидразонометиленфурил-5-фосфонистой кислоты. К раствору 0,1 моль N,N-диметилгидразона фурфурола в 100 мл бензола при 5 0С и перемешивании в течение 1 часа прибавляли раствор 0,1 моль трехбромистого фосфора в 150 мл бензола. В течение 1 часа температуру реакционной смеси подняли до 20 0 С и продолжали перемешивание еще 1 час. После этого к раствору при 5 0С и перемешивании в течение 1 часа прибавляли раствор 0,5 моль морфолина и 0,3 моль тритэиламина в 100 мл гексана. После чего в течение получаса поднимали температуру реакционной смеси до 20 0С и продолжали перемешивание еще 2 часа при этой температуре. Реакционную смесь отфильтровывали, фильтрат упаривали в вакууме, остаток переганяли. Выход 76%. Ткип=149-1500С
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.