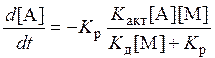 .
.
При достаточно высоких давлениях деактивация более вероятна, чем распад, тогда реакция не зависит от давления:
![]() ,
, 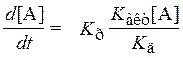
и описывается уравнением, характерным для мономолекулярной реакции. При низком давлении
![]() ,
, 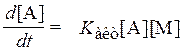 ,
,
то есть, скорость реакции пропорциональна давлению и соответствует бимолекулярной реакции. Между этими предельными случаями процесс не соответствует ни реакции первого порядка, ни реакции второго порядка. Тепловой распад N2O5 →NО2+NO3 является важным процессом, который при стратосферном давлении относится к промежуточному классу.
Термолекулярные реакции A+B+M→C+M
Вероятность реакции с участием трех частиц в результате одновременного столкновения всех трех частиц крайне мала. Однако оказывается, что в общем случае термолекулярные реакции можно описать в терминах теории активированного комплекса.
Первоначальный шаг:
![]() .
.
Второй шаг:
![]() .
.
Третий шаг: если не успела произойти деактивация, возбужденная молекула распадается на исходные частицы
![]() .
.
Процесс является обратным по отношению к мономолекулярному распаду.
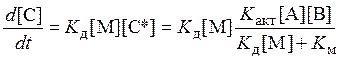 .
.
Здесь для компоненты С* предполагается равновесное состояние как в предыдущем случае. Если Км >> Кд[М], кажущаяся кинетическая скорость реакции будет линейно зависеть от давления.
Большинство термолекулярных процессов в средней атмосфере происходит именно таким образом. Однако, как и в случае бимолекулярных процессов, реакция может не относиться ни ко второму, ни к третьему порядку.
Замечание. Помимо рассмотренных выше реакций между частицами, находящимися в газовой фазе, очень важную роль в химии атмосферы играют так называемые гетерогенные реакции, то есть, реакции между веществами, находящимися в различных фазовых состояниях. В частности, гетерогенные химические реакции соединений хлора на поверхности частиц полярных стратосферных облаков являются одной из причин образования антарктической озонной дыры (разд. 11).
8.3. Влияние динамики на химию атмосферы
Динамика атмосферы имеет дело с движением воздуха и изменением его термодинамического состояния (давления, температуры, плотности). Помимо прочего, динамика оказывает также влияние и на состав атмосферы. Во-первых, температура воздуха влияет на скорости протекания многих химических реакций и на фазовое состояние отдельных составляющих (например, воды). Во-вторых, ветры перемещают отдельные молекулы в пространстве. Поэтому не только химия непосредственно влияет на наблюдаемые концентрации отдельных химических компонент атмосферы, но также и температура и перенос, являющиеся неотъемлемыми атрибутами динамики атмосферы.
Скорости многих химических реакций зависят от давления. Однако между давлением и высотой над поверхностью Земли имеется очень тесная связь, следующая из барометрической формулы (см. разд. 13.1). Поэтому давление можно всегда рассматривать как независимую вертикальную переменную. В этом случае величина давления просто задается на начальном этапе решения задачи.
Образование и разрушение химических соединений и их перенос тесно связаны друг с другом. Как будет показано в разд. 14, эволюция во времени некоторой физической величины q, характеризующей жидкость или газ в фиксированной точке пространства, определяется соотношением
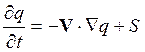 , (8.2)
, (8.2)
где
t – время, V- вектор скорости, ![]() -
оператор градиента[6].
Первый член в правой части выражения определяет изменение физической величины
за счет притока (или оттока), второй – за счет образования (или уничтожения).
Очевидно, аналогичное выражение справедливо и для концентрации некоторого
вещества A:
-
оператор градиента[6].
Первый член в правой части выражения определяет изменение физической величины
за счет притока (или оттока), второй – за счет образования (или уничтожения).
Очевидно, аналогичное выражение справедливо и для концентрации некоторого
вещества A:
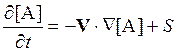 .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.