DGR = DGHNO3 + DGOH - DGNO3 - DGH2O = 17.8 ккал/моль.
Следовательно, реакция термодинамически невозможна без внешнего источника энергии, и нам нет необходимости дожидаться результатов лабораторных исследований, чтобы исключить ее из рассмотрения.
Тенденция к увеличению энтропии системы, очевидно, действует тем сильнее, чем выше температура (см. (8.1)). Поэтому, если какой-то процесс сопровождается увеличением энтропии, но является эндотермичным, то при достаточно низких температурах он не реализуется. Зато он может реализоваться при повышении температуры до определенного уровня.
Другое важное применение термодинамических данных – оценка экзотермичности химических реакций, которые могут влиять на тепловой баланс атмосферы.
Например:
O + O2 + M → O3 + M,
где М – произвольный атом или молекула (для отвода лишнего импульса).
DНR = DНO3 + DНМ - DНО - DНО2- DНМ = DНO3 - DНО= 34.1 – 59.5 = -25.4 ккал/моль.
Этот процесс является важным источником нагрева в верхней части средней атмосферы.
Дополнительным источником энергии для протекания эндотермической реакции может служить фотон. Энергия фотона с длиной волны l:
Е = hc/l = hn, n = c/l- частота, h = 6.6×10-27 эрг×с – постоянная Планка.
Например, рассмотрим фотолиз О2 с образованием двух атомов О в основном (наинизшем по энергии) состоянии 3Р
О2 + hn → 2O(3Р),
DНR = 119.10 ккал/моль - hc/l.
Чтобы получить DНR £ 0, фотон должен обладать энергией не меньшей 119.10 ккал/моль = 8.27×10-15 эрг на 1 молекулу. Этой энергии отвечает длина волны l = 240 нм. Именно такая длина волны соответствует длинноволновой границе фотолиза молекулярного кислорода.
Термодинамический подход позволяет определить, будет ли та или иная реакция идти при определенной температуре. Однако такой подход не дает ответа, насколько быстро реакция будет протекать. Это уже предмет изучения химической кинетики.
Наблюдаемая концентрация большинства составляющих атмосферы зависит от баланса между скоростями фотохимического образования и разрушения, а также от скорости переноса в атмосфере (перемешивания).
Все многообразие химических реакций разделяют на три типа:
А ® В + С - мономолекулярная или первого порядка (реакция распада);
А + В ® - реакция второго порядка или бимолекулярная;
А + В + С ® - третьего порядка или термолекулярная[2].
Скорость химической реакции характеризует скорость образования продуктов или скорость исчезновения реагентов. Для реакции А ® С + Dскорость Кт определяется по формуле[3]:
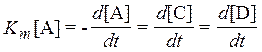 .
.
Отсюда
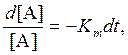
![]() .
.
Здесь квадратные скобки обозначают концентрацию того или иного вещества. Время 1/Кт уменьшения [А] в е раз называют временем жизни составляющей А.
Если мы хотим знать, влияют ли процессы переноса на концентрацию компоненты, нужно сравнить химическое время жизни компоненты с постоянной времени, характеризующей процесс переноса. Если химия идет много быстрее, переносом в первом приближении можно пренебречь (см. разд. 8.3).
Для бимолекулярной реакции А + В ® С + Dскорость описывается формулой[4]:
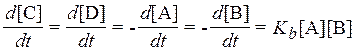 .
.
Размерность константы - см3с-1. Чтобы оценить химическое время жизни какой-либо компоненты в реакциях второго и третьего порядка, их сводят к псевдомонореакции.
Например, для бимолекулярной реакции можно записать
![]() ;
;
аналогично для термолекулярной реакции
![]() .
.
Тогда
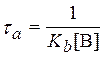 или
или
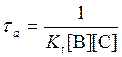 .
.
Такие выражения используются только тогда, когда концентрации [В] и [С] могут считаться неизменными в течение времени tа. Это значит, что [В]>>[A] в случае бимолекулярной реакции, и [B], [C]>>[A] в случае термолекулярной реакции. Например, концентрация атомарного кислорода на высотах стратосферы на много порядков меньше концентрации молекулярного кислорода. Поэтому в ходе реакции образования озона при соединении атомарного кислорода с молекулярным в присутствии третьей частицы концентрации молекулярного кислорода и молекул воздуха ([M]) могут считаться неизменными
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.