Специфика радиолиза воды заключается в том, что при действии излучения в ней одновременно образуются частицы с противоположными свойствами – окислительными и восстановительными, которые взаимно нейтрализуют друг друга. Однако введением дополнительного акцептора (соответствующего вещества) можно придать системе либо чисто окислительные, либо чисто восстановительные свойства. Акцептор, кроме того, в ряде случаев способствует осуществлению цепных процессов – непрерывному воспроизводству частиц, участвующих в окислительных или восстановительных реакциях. Явление радиолиза воды имеет, по-видимому, большое практическое значение; на основе этого явления разрабатываются методы радиационной очистки загрязненных природных вод.
Третий вид равновесия в воде связан с наличием в ней изотопов. Изотопный состав воды определяется существованием трех изотопов водорода и шести изотопов кислорода.
Изотопы водорода Н1 (Н – протий), Н2 (D – дейтерий), Н3 (Т – тритий) распространены неодинаково (Щербина, 1972): Н1 – 99,9844%, Н2 – 0,0156%, Н3 – 3 10-16 %. Дейтерий изучен сравнительно хорошо, поскольку он широко используется в связи с термоядерными реакциями. Отношение H/D в гидросфере составляет около 6400. Дейтерий образует тяжелую воду D20, свойства которой отличаются от свойств Н20 (табл. 11).
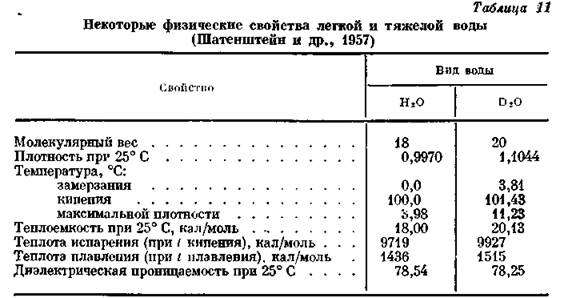
Как видно из таблицы, существенная разница заключается в теплотах испарения и плавления, в температурах замерзания, кипения и т. д. Неодинаковость свойств обусловливает различие в упругости водяного пара: она выше у обычной воды и ниже у тяжелой воды.
Особенно резко отличается тяжелая вода от обычной по физиологическим свойствам. Она является ядом для всего живого, так как сильно замедляет сложные биохимические реакции, происходящие в животных и растительных организмах.
Диэлектрическая проницаемость тяжелой воды лишь немногим меньше этого параметра у легкой. Однако растворяющая способность по отношению к электролитам у тяжелой воды заметно хуже, чем у обычной, тогда как неэлектролиты растворяются лучше.
В целом необходимо подчеркнуть, что специфические свойства тяжелой воды связаны с со строением. Структура ее считается идентичной структуре обычной воды, но молекула отличается от обычной меньшим расстоянием О – D (по сравнению с О – Н) при большой массе. Вследствие этого в льдоподобном каркасе молекулы тяжелой воды оказываются ближе друг к другу, благодаря чему дейтериевая связь заметно прочнее водородной. Установлено, что по мере роста температуры разница между физическими свойствами тяжелой и обычной воды начинает сглаживаться.
Тритий является радиоактивным изотопом водорода с периодом полураспада, равным 12,26 лет. Он образуется только в верхних слоях атмосферы Земли при взаимодействии космических лучей с ядрами некоторых элементов (азота, кислорода и др.). Количество трития ничтожно мало, отношение Н/Т составляет от 10 17до 1018. В годы с 1952 по 1962, когда производилось интенсивное испытание термоядерного оружия, в атмосферу было выброшено большое количество искусственно образованного трития («бомбовый» тритий). После 1962 г. в связи с резким сокращением атомных взрывов идет процесс уменьшения количества «бомбового» трития в атмосфере.
Окисляясь, тритий дает молекулу воды Т20. Поскольку масса трития в три раза превышает массу обычного водорода (протия), свойства тритиевой воды значительно отличаются от свойств воды обычной. Изученность этих свойств, однако, пока слабая; содержание тритиевой воды в гидросфере очень низкое.
Из шести изотопов кислорода: О14, О15, О16, О17, О18 и О19 — только три являются стабильными. Жизнь О14, О15 .и О19 измеряется секундами, поэтому они не имеют значения. Содержание стабильных изотопов кислорода равно (Щербина, 1972): О16 – 99,759%, О17–0,037%, О18 – 0,2039%.
Наибольшую роль (кроме обычного кислорода О16) играет О18. Соотношение 016/018 в среднем составляет в гидросфере около 2000. Вода Н2018 распространена сравнительно широко.
По данным А. И. Шатенштейна, Е. А. Яковлева и др., плотность воды Н2015 достигает 1,1134 при температуре 25° С, а упругость ее пара ниже, чем у воды Н20, и несколько выше, чем у воды D20.
В природной воде присутствуют все изотопы водорода и кислорода, но главную роль играют обычная вода (Н20), дейтериевая вода (D20) и вода, образованная тяжелым кислородом (Н2018).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.