Поскольку диэлектрическая проницаемость воды зависит от температуры (уменьшаясь с ее ростом) и от давления, представляет интерес значение этой величины в близ- и надкритическом состояниях воды, т. е. в условиях больших глубин, где температуры превышают 374°С, а давление 220 бар (2,2-107 Па). По данным Е. У. Франка (1971), диэлектрическая проницаемость с глубиной довольно резко уменьшается. При 500°С и 1000 бар (108 Па) она равна примерно 8—9. Эти результаты свидетельствуют о том, что водородная связь все еще играет роль в структуре воды при надкритической ее температуре и высоком давлении. Не вполне ясен лишь вопрос о доле участия в надкритической воде структу- рированных агрегатов; Е. У. Франк полагает, что количество их в общем невелико.
Несмотря на уменьшение растворяющей способности воды в области высоких температур и давлений, экспериментальный материал свидетельствует о том, что физическая величина растворимости многих веществ сильно возрастает в этих условиях (табл. 9). По-видимому, такое явление в значительной мере связано со структурными изменениями самих растворяющихся веществ, образующих более растворимые формы.

Ионное равновесие воды
Для воды характерно ионное равновесие. Молекулы воды диссоциируют на ионы в соответствии со схемой
Н20 ↔ Н+ + ОН-. Опираясь на закон действующих масс, можно написать
К [Н+] [ОН-]
[Н20] '
Вследствие того, что концентрация молекул воды, распавшихся на ионы, по сравнению с общим их количеством крайне мала, величину [Н20] можно считать постоянной. Тогда из выражения (3) получим
К [Н20] = Н [ОН-].
Левая часть выражения представляет собой так называемое ионное произведение воды (Кв). Оно равно
КВ = [Н+][ОН-]
* Правильнее писать не Н+, а Н30+, поскольку ион водорода в водном растворе гидратируется, образуя ион гидроксония Н3О+, но для простоты будем пользоваться обозначением Н*.
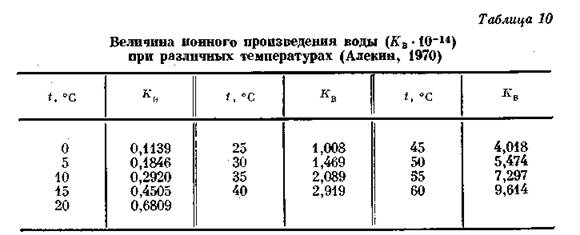
Величина ионного произведения воды в значительной мере зависит от температуры, в меньшей – от давления. По данным X. С. Харнеда и Б. Б. Оуэна (табл. 10), ионное произведение изменяется от 0,1139-10-14 при 0° С до 9,614-10-14 при 60° С, т. е. примерно в 85 раз. При t=22° С и атмосферном давлении Кв = 10-14. Поскольку в чистой воде количество ионов водорода и гидроксила одинаково, можно написать
[Н+] = [ОН-] = 10 -7.
Концентрации ионов Н+ и ОН" из-за очень малой их величины принято выражать в виде логарифмов, взятых с обратным знаком:
PH = -lg[H+] , POH= -lg[OH-].
Очевидно, что в чистой воде при так называемых нормальных условиях рН = рОН = 7; реакция является нейтральной.
Большой интерес представляет величина ионного произведения воды в близ- и надкритических условиях, т.е. при высоких температурах и давлениях. Поскольку Кл возрастает с увеличением этих параметров, вероятно, в близ- и надкритических состояниях Кв должна достигать высоких значений.
С. Д. Хаманн показал, что в проведенном им эксперименте при t - 1250° С и давлении 200 кбар (2 1010 Па) удельная электропроводность чистой воды повысилась в сотни миллионов раз, и предположил, что это обусловлено увеличением ионного произведения поды по крайней мере на 12 порядков. Аналогичные результаты описывает Е. У. Франк. По его данным, при температуре 1000° С и давлении 100 кбар (1010 Па) Кв составило 10 –2– 10 -1 и вода по электропроводности приблизилась к насыщенным растворам щелочных хлоридов.
Следовательно, диссоциация воды в условиях больших глубин резко увеличивается, и вода может присутствовать на таких глубинах преимущественно в виде ионов Н+ и ОН-.
Необходимо отметить, что кроме процессов спонтанной диссоциации воды на ионы имеет место возбужденная ее диссоциация в природных условиях. Последняя происходит под влиянием излучений и называется радиолизом воды. По характеру излучения, вызывающие радиолиз, могут быть самыми различными: это ускоренные электроны, рентгеновы и у-лучи и т. д. Эффект, который они производят, зависит от мощности дозы излучения. В результате в воде появляются (Долин и др., 1973): а) гидратированный электрон и атомарный водород – короткоживущие восстановители; б) гидроксильный и гидроперекисный (Н02) радикалы, надперекись (Н203) – короткоживущие окислители; в) молекулярные продукты радиолиза воды – водород, перекись водорода и кислород.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.