|
H (0.30) |
||||
Li(1.34) |
C(0.77)(0.67)* (0.60)** |
N(0.73)(0.61)* (0.55)** |
O(0.74)(0.57)* |
F(0.72) |
Na(1.54) |
Si(1.17) |
P(1.10) |
S(1.04) |
Cl(0.99) |
K(1.96) |
Ge(1.22) |
As(1.21) |
Se(1.17) |
Br(1.14) |
Rb(2.11) |
Sn(1.40) |
Sb(1.41) |
Te(1.37) |
I(1.33) |
Для примера приведём несколько значений рассчитанных по формуле 9.11 и экспериментальные длины связи в ангстремах.
HF - 0.85 и 0.95, HCl - 1.21 и 1.27, HBr - 1.38 и 1.41.
9.7. Роль степени ионности связи.
В двухатомной молекуле степень ионности связи мы характеризовали по методу ВС в виде волновой функции ионно-ковалентного резонанса:
Y = yков + lyион; (9.12)
или весом (вкладом) атомной орбитали в распределении электронной плотности по методу МО:
Y = yА + lyВ. (9.13)
Для многоатомных молекул можно указать несколько ионных структур. Например, для молекулы воды они таковы:
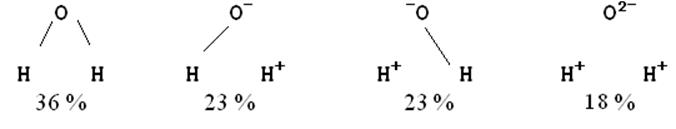
Указанные веса рассчитаны из экспериментальных данных по дипольному моменту (по Полингу 32 : 3´2 : 2´3 : 22). Однако такое описание является весьма приближённым, т.к. не учитывает электронной корреляции (если одна связь уже ионизована, то вероятность ионизации другой понижается), а таже поляризацию несвязывающих электронов. Кроме того, предположение о том, что электроотрицательность какого-либо атома постоянна, справедливо только для двухатомных молекул. В многоатомных молекулах полярные и ионные эффекты в одной связи индуцируют соответствующие эффекты в соседних связях. Т.о. коэффициент l зависит не только от разностей электроотрицательностей (хА - хВ), но и от электроотрицательностей других атомов и групп, присоединённых к связи А-В. В качестве примера рассмотрим карбонильную группу:
![]() С = О.
С = О.
У этой группы большой дипольный момент (m = 2.7 D), что указывает на концентрацию валентных электронов вблизи атома кислорода. Неподелённая пара электронов (2р)2 атома кислорода испытывает со стороны других электронов большее отталкивание, чем в свободном кислороде. Отсюда потенциал ионизации кислорода в карбонильной группе (11 эВ) ниже, чем для свободного атома кислорода (13.5 эВ). Если у формальдегида Н2СО один или несколько атомов водорода заменить на группы, электроотрицательности которых отличаются от электроотрицательностей атома водорода, то это должно повлиять на состояние атома углерода, и соответственно, на коэффициент l в волновой функции МО связи =С=О. А в конечном итоге такая замена отразится и на потенциале ионизации электронов неподелённой пары. В таблице 9.3 представлены значения полярности (ионности) карбонильных соединений и их потенциалы ионизации. Электроотрицательности атомов, входящих в указанные соединения, таковы: хС = 2.5, хО = 3.5, хН = 2.1.
Таблица 9.3. Полярность карбонильных соединений и их потенциал ионизации.
|
молекула |
формула |
доля ионности, % |
потенциал ионизации, эВ |
|
глиоксаль |
|
30 |
11.4 |
|
формальдегид |
|
35 |
10.87 |
|
ацетальдегид |
|
42 |
10.23 |
|
ацетон |
|
46 |
9.71 |
Приведённые примеры иллюстрируют трудности на пути перехода от общего рассмотрения, основанного на предположении аддитивности связей, к более тонкому анализу, где учитываются неаддитивность и взаимодействие между связями.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.