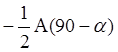 .
.
А(a) - 0.5А(90O - a) (9.8)
Обобщая сказанное, можно сделать следующий вывод: в энергию произвольной системы электронов и ядер помимо энергии атомов Еат, составляющих систему, кулоновской энергии Сij вносят свой вклад энергия спаренных электронов Аij, энергия по неспаренным электронам А*ij (электроны из разных связей и поэтому их спины независимы), а также энергия по орбиталям с параллельными спинами А**ij.
Е = SЕат + SСij + SАij - 0.5SА*ij - SА**ij . (9.9)
Из выражения 9.9 видно, что максимальная энергия связи будет тогда, когда электроны, не принимающие участия в образовании ковалентной связи, будут отталкиваться друг от друга. Уравнение 9.9, соответствующее приближению полного спаривания, служит основой всей стереохимии. При его выводе было сделано ряд упрощений:
- все АО связаны между собой попарно;
- не учитываются все интегралы перекрывания S;
- не учитываются все ионные и полярные составляющие;
- учитываются только простые обменные интегралы.
Приближение полного спаривания в качественном отношении справедливо, но от него трудно ждать удовлетворительных количественных результатов (ошибка порядка 70 %).
9.4. Молекула воды (метод ППЭС).
Применение метода ППЭС проиллюстрируем на молекуле воды. Орбитали атомов водорода На и Нb образуют с орбиталями кислорода О(2рх) и О(2рy) углы a* и a** (см. рис.9.4). Такой схеме спаривания согласно уравнению 9.9 соответствует следующее выражение для обменной энергии:
Еобм = + А(рх;На) + А(рy;Нb) - 0.5А(рх;Нb) - 0.5А(рy;На) -
- 0.5 А(Нa;Нb) - 0.5 A(px;py). (9.10)
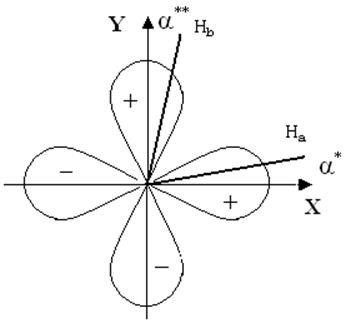
Рис.9.4. Полное спаривание в молекуле Н2О.
В выражении 9.10 имеются два интеграла с коэффициентом + 1 (вклад электронов, участвующих в образовании ковалентных связей), четыре с коэффициентом - 1/2 (вклад непосредственно несвязанных электронов) и нет интегралов с коэффициентом - 1 (т.к. нет электронов со связанными параллельными спинами). Член A(px;py) равен нулю, т.к. орбитали px и py ортогоналены, член А(Нa;Нb) отвечает за отталкивание далеко стоящих друг от друга атомов водорода. Поэтому оба этих члена от угла не зависят. Из первых четырёх членов выражения 9.10 и выражения 9.7 вытекает, что энергия минимальна, когда a* = a** = 0O, т.е. когда угол Н-О-Н равен 90O. Применяя для кулоновской энергии (интеграл С) формулу, аналогичную 9.10, нетрудно показать, что кулоновская энергия не вносит вклада в эффекты, зависящие от направления. Выполненный анализ служит основой стереохимии двух р-связей; он позволяет объяснить и факт приближённого постоянства энергии связи. Теория, развитая для молекулы воды в равной мере применима для других молекул, имеющих не более, чем три р-электрона. Применима она и когда присоединённые атомы разные (с учётом принятых приближений). Важно отметить, что формулой, аналогичной 9.10, можно пользоваться для вычисления изменения энергии, когда углы a* и a** отклоняются от своих равновесных значений, что позволяет рассчитать частоту деформационных колебаний n. Для молекулы Н2О расчёт даёт n = 1660 см-1, а эксперимент - 1595 см-1.
9.5. Роль энергии отталкивания.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.