Молекула, обладающая постоянным дипольным моментом, может индуцировать в другой молекуле (неполярной или полярной) дипольный момент. Индуцированный диполь ориентируется таким образом, что между постоянным и индуцированным моментами возникает сила притяжения (дебаевская сила). Взаимодействие постоянного дипольного момента с наведённым дипольным моментом приводит к понижению энергии системы на величину:
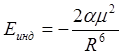 ,
(13.4)
,
(13.4)
где a - поляризуемость первоначально не полярной молекулы, m - дипольный момент полярной молекулы, R - расстояние между центрами диполей. Если же обе молекулы имеют постоянные дипольные моменты m1 и m2 и обладают поляризуемостью a1 и a2, тогда средняя потенциальная энергия их взаимодействия определяется выражением:
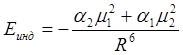 .
.
Если индуцированный дипольный момент равен моменту, вызвавшему его, то энергия взаимодействия такова:
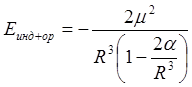 .
(13.5)
.
(13.5)
Энергия индуцированного взаимодействия (как и ориентационного) убывает пропорционально шестой степени от расстояния, но не зависит от температуры. Индукционное взаимодействие существенно для молекул со значительной поляризуемостью (молекулы с сопряжёнными связями). Индукционное взаимодействие между двумя молекулами зависит от присутствия других полярных молекул и, следовательно, оно не аддитивно.
13.4. Дисперсионное взаимодействие (эффект Лондона).
Для молекул со сферически симметричным распределением заряда электростатическое взаимодействие исключается, например, атомы инертных газов. Но и они при сильном охлаждении и под давлением сжижаются и отвердевают (кроме гелия). Силы, действующие в таком случае называют дисперсионными.
Решение уравнения Шредингера для системы из двух молекул методом возмущений указывает на существование энергии ориентационного (электростатического), индукционного и дисперсионного взаимодействия. Если первые два можно понять с позиций электростатики, то дисперсионное взаимодействие может быть объяснено только на основе квантовой механики. Грубая модель: ядро атома и движущийся вокруг него электрон можно рассматривать как мгновенный диполь, направление которого изменяется с частотой 1015 Гц. При встрече двух атомов мгновенные диполи ориентируются относительно друг друга и их направления изменяются синхронно. Это понижает потенциальную энергию системы на величину, называемую энергией дисперсионного взаимодействия (Едисп). Согласно Лондону
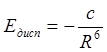 , (13.6)
, (13.6)
где с - константа, которая для одинаковых молекул определяется выражением:
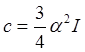 .
(13.7)
.
(13.7)
Для разных молекул:
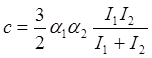 .
(13.8)
.
(13.8)
Здесь a - поляризуемость молекулы, I - потенциал ионизации. Поляризуемость молекулы можно определить с помощью коэффициента преломления n из соотношения:
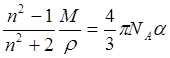 .
.
Дисперсионное взаимодействие характерно для всех без исключения молекул. Другой важной особенностью дисперсионного взаимодействия является его аддитивность. Т.е. для трёх молекул
Е123 = Е12 + Е23 + Е13. (13.9)
Таблица 13.1. Энергии ван-дер-ваальсовского взаимодействия, эВ (1 Д = 3.336×10-30 Кл×м).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.