Наиболее полная информация о вкладе различных факторов в конечное значение энергии водородной связи имеется для льда.
Составляющие энергии водородной связи в кристалле льда (ккал/моль):
- Электростатическая энергия - - 6;
- Энергия делокализации (ион-ковалентного резонанса) - - 8;
- Энергия отталкивания перекрывающихся зарядовых
облаков, не входящих в водородную связь атомов - + 8.4;
- Энергия дисперсионных сил - - 3.
Полная энергия (теоретическая) - - 8.6.
Экспериментальное значение (из теплоты сублимации) - - 6.1.
В заключении следует ещё раз отметить огромную роль водородной связи в неживой и живой природе Земли. В частности, аномально высокие значения диэлектрической постоянной СН3ОН, Н2О, НCN; упорядоченное расположение полипептидных цепей в структурах белка, поперечные связи в двойной спирали нуклеиновых кислот и их роль во всех биологических процессах.
13.2. Силы Ван-дер-Ваальса. Электростатическое взаимодействие.
Силы
притяжения между молекулами называются силами Ван-дер-Ваальса. Именно эти силы
вызывают отклонение газов от идеальности и они же приводят к сжижению газов.
Силы Ван-дер-Ваальса являются дальнодействующими, т.к. они возникают уже на
больших расстояниях (несколько ангстрем) и энергия взаимодействия довольно
медленно спадает с расстоянием » r-n, где n =
1 ¸ 6. Расстояние между молекулами в жидкостях и твердых
телах » 3 ¸ 5 ![]() , а
энергия взаимодействия 0.24 ¸ 1.2 ккал/моль (0.01 ¸ 005 эВ, т.е. в 100 раз ниже энергии обычной химической связи).
Различие между химическими силами и межмолекулярным взаимодействием в первую
очередь количественное. Природа сил в том и другом случае одна – электрическая.
Взаимодействие двух молекул на сравнительно больших расстояниях имеет характер
возмущения электронного облака одной молекулы электронным облаком другой
молекулы. При этом энергия системы понижается на величину энергии возмущения (называемой
энергией межмолекулярного взаимодействия). Квантово-механический расчёт
показывает, что она состоит из энергии возмущения первого порядка –
электростатической и энергии возмущения второго порядка – индукционной и
дисперсионной. Электростатическое взаимодействие включает в себя взаимодействие
электрически заряженных атомов (ионов), постоянных дипольных моментов,
квадрупольных, октупольных и других электрических моментов молекул. Наиболее
важным является взаимодействие постоянных дипольных моментов. При сближении
диполи ориентируются так, чтобы энергия системы стала минимальной. Если l
- длина диполя, R - расстояние между центрами диполей, то в случае
слипания в линию энергия взаимодействия такова:
, а
энергия взаимодействия 0.24 ¸ 1.2 ккал/моль (0.01 ¸ 005 эВ, т.е. в 100 раз ниже энергии обычной химической связи).
Различие между химическими силами и межмолекулярным взаимодействием в первую
очередь количественное. Природа сил в том и другом случае одна – электрическая.
Взаимодействие двух молекул на сравнительно больших расстояниях имеет характер
возмущения электронного облака одной молекулы электронным облаком другой
молекулы. При этом энергия системы понижается на величину энергии возмущения (называемой
энергией межмолекулярного взаимодействия). Квантово-механический расчёт
показывает, что она состоит из энергии возмущения первого порядка –
электростатической и энергии возмущения второго порядка – индукционной и
дисперсионной. Электростатическое взаимодействие включает в себя взаимодействие
электрически заряженных атомов (ионов), постоянных дипольных моментов,
квадрупольных, октупольных и других электрических моментов молекул. Наиболее
важным является взаимодействие постоянных дипольных моментов. При сближении
диполи ориентируются так, чтобы энергия системы стала минимальной. Если l
- длина диполя, R - расстояние между центрами диполей, то в случае
слипания в линию энергия взаимодействия такова:
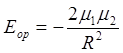 , (13.1)
, (13.1)
где m = el - дипольный момент молекулы. Для бокового слипания
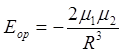 .
(13.2)
.
(13.2)
Формулы 13.1 и 13.2 действительны для расчёта взаимодействия в кристаллах, где ориентация неизменна. В газах и жидкостях тепловое движение приводит к всевозможным ориентациям и здесь используется следующее выражение:
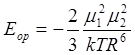 . (13.3)
. (13.3)
Силы, которые обуславливают энергию по ур. 13.3, называют ориентационными или силами Кезома.
13.3. Индукционное взаимодействие. Эффект Дебая.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.