



1. ЗНАЧИМОСТЬ ТЕМЫ: Химическая кинетика изучает закономерности протекания реакций во времени и их механизмах. Это наиболее фундаментальная наука о химических реакциях. Она имеет существенное значение для биологии и медицины, так как изучение механизмов реакций позволяет более глубоко познать многие биологические процессы, установить влияние на их прохождение многих факторов, среди которых особенно важную роль играют биологические катализаторы, называемые ферментами. Кинетика используется для выяснения механизмов действия лекарственных средств и разложение их молекул в тканях живых организмов (раздел фармакологии), имеющий большое значение для медицинской науки и практики.
2. ЦЕЛЬ ЗАНЯТИЯ: Уметь теоретически обосновать и экспериментально подтверждать возможность течения химических процессов, прогнозировать влияние различных факторов на изменение скорости реакции и смещение их равновесия.
3. ЗАДАЧИ: после изучения темы
а) студент должен знать:
- основные понятия химической кинетики: скорость и механизм химической реакции, порядок и молекулярность;
- влияние различных факторов на скорость химической реакции;
- кинетические уравнения простых и сложных реакций;
- влияние температуры на скорость химических реакций;
- понятие о катализе и катализаторах;
- кинетическое описание ферментативных реакций.
б) студент должен уметь:
- составлять кинетические уравнения простых реакций;
- рассчитывать время полураспада радионуклидов;
- рассчитывать константы скорости химических реакций нулевого, первого и второго порядков;
- рассчитывать изменение скорости химических реакций при изменении температуры;
- рассчитывать энергию активации химических реакций по кинетическим данным;
- производить расчеты, используя уравнение ферментативной кинетики Михаэлиса-Ментен.
в) приобрести практические навыки:
- по выполнению расчетов константы скорости химических реакций, времени полураспада радионуклидов, энергии активации;
- определять скорость химической реакции в зависимости от концентрации и температуры.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Предмет химической кинетики. Химическая кинетика как основа для изучения скорости и механизма биохимических процессов.
2. Скорость химической реакции по веществу для гомогенных и гетерогенных превращений. Кинетические кривые.
3. Закон действующих масс. Выражение для скорости химической реакции. Константа скорости. Порядок реакции. Молекулярность.
4. Кинетические уравнения необратимых реакций 0, 1, 2 порядков. Время полуреакции.
5. Понятие о течении сложных реакций: параллельных, последовательных, сопряженных, обратимых, цепных.
6. Зависимость скорости реакции от температуры. Теория активных соударений. Температурный коэффициент. Энергия активации. Уравнение Аррениуса.
7. Теория активного комплекса. Объяснение действия катализатора с позиций данной теории. Катализ и катализаторы.
8. Кинетика ферментативных реакций. Уравнение Михаэлиса-Ментен. Молекулярная активность фермента.
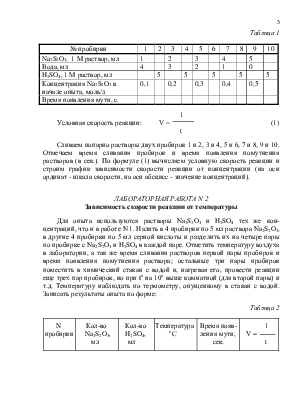
Опыт сводится к измерению времени образования заметного на глаз количества серы в результате реакции:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3
H2S2O3 = H2O + SO2 + S ↓
В 10 пробирок, помеченных карандашом, налить из бюреток растворы натрия тиосульфата, серной кислоты и воды в количествах, указанных ниже:
|
№ пробирки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Na2S2O3, 1 M раствор, мл |
1 |
2 |
3 |
4 |
5 |
|||||
|
Вода, мл |
4 |
3 |
2 |
1 |
0 |
|||||
|
H2SO4, 1 М раствор, мл |
5 |
5 |
5 |
5 |
5 |
|||||
|
Концентрация Na2S2O3 в начале опыта, моль/л |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
|||||
|
Время появления мути, с. |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.