При конкурентном ингибировании субстрат и ингибитор конкурируют за один и тот же центр связывания на ферменте. Субстрат в высоких концентрациях вытесняет ингибитор с фермента, поэтому максимальная скорость при этом типе торможения не претерпевает изменения. Для достижения же половины максимальной скорости реакции необходимы более высокие концентрации субстрата: ведь часть каталитических участков занята ингибитором, который блокирует фермент и не дает возможности субстрату превратиться в продукт.
Схема процесса в данном случае записывается следующим образом:
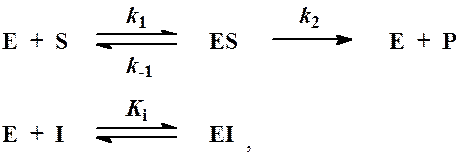
где 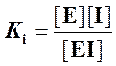 ─ константа диссоциации
комплекса фермент-ингибитор.
─ константа диссоциации
комплекса фермент-ингибитор.
Мы можем записать уравнение материального баланса:
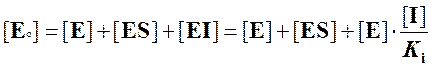 .
.
Отсюда
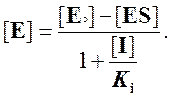
Используя условие квазистационарного состояния,
получаем:
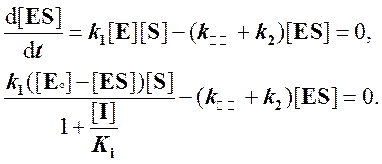
Решаем относительно [ES]:
|
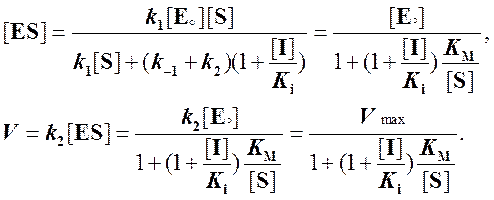
Как мы видим,
выражение (5) отличается от выражения (3) множителем при КM, равном 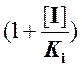 . Отсюда следует, что при конкурентном
ингибировании значение константы Михаэлиса увеличивается на величину этого
множителя, а величина максимальной скорости остается без изменения. Таким
образом, при конкурентном ингибировании уменьшается сродство фермента к
субстрату.
. Отсюда следует, что при конкурентном
ингибировании значение константы Михаэлиса увеличивается на величину этого
множителя, а величина максимальной скорости остается без изменения. Таким
образом, при конкурентном ингибировании уменьшается сродство фермента к
субстрату.
На рис. 5 представлены графики зависимости скорости ферментативной реакции от концентрации субстрата в присутствии конкурентного ингибитора в координатах Лайнуиве-
ра - Берка.
Из графика Лайнуивера
- Бэрка (рис. 5)
видно, что полученные в отсутствие и в присутствии ингибитора прямые пересекаются
на оси ординат. Ордината точки пересечения численно равна обратной величине
максимальной скорости реакции, а абсцисса прямой, полученной в присутствии ингибитора,
дает обратную величину KMi, равную 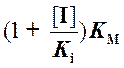 .
.
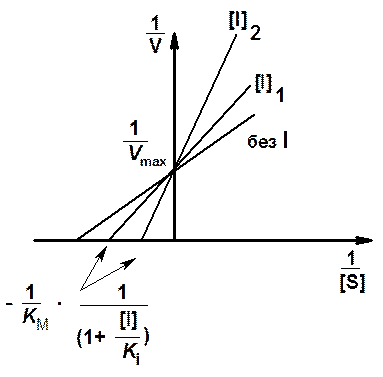
Рис. 5.Зависимость скорости ферментативной реакции от концентрации субстрата в отсутствие и в присутствии двух разных концентраций ([I]1 и [I]2) конкурентного ингибитора в координатах Лайнуивера - Бэрка
Вычислив по графику KMi, мы можем рассчитать Ki по формуле
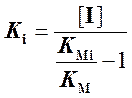 .
.
График Иди - Хофсти для конкурентного ингибирования представлен на рис. 6. Из этого графика видно, что прямые, полученные в отсутствие и в присутствии ингибитора, пересекаются в точке на оси ординат.
Ордината точки пересечения численно равна величине максимальной скорости реакции. Величину КMi получают путем деления длины отрезка, отсекаемого на оси ординат, на длину отрезка, отсекаемого на оси абсцисс.
Графический анализ различных типов ингибирования в координатах Эйзенталя и Корниш-Боудена представлен на рис. 7. Из рис. 7, а видно, что при конкурентном типе ингибирования точка пересечения прямых, построенных в координатах КM; Vmax, смещается вправо, при этом изменяется ее абсцисса (вместо КM мы получаем при ингибировании KMi), а ордината остается неизменной и численно равной Vmax.
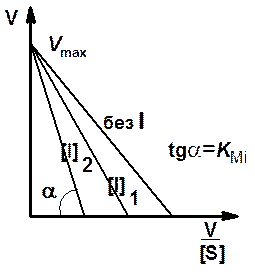
Рис. 6. Зависимость скорости ферментативной реакции от концентрации субстрата в отсутствие и в присутствии двух разных концентраций ([I]1 и [I]2) конкурентного ингибитора в координатах Иди - Хофсти
2. Неконкурентное ингибирование
Неконкурентные ингибиторы не влияют на связывание субстрата с ферментом, а изменяют максимальную скорость реакции.
Эта система схематически может быть представлена в
следующем виде:
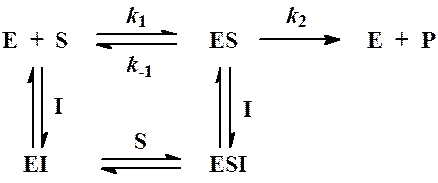
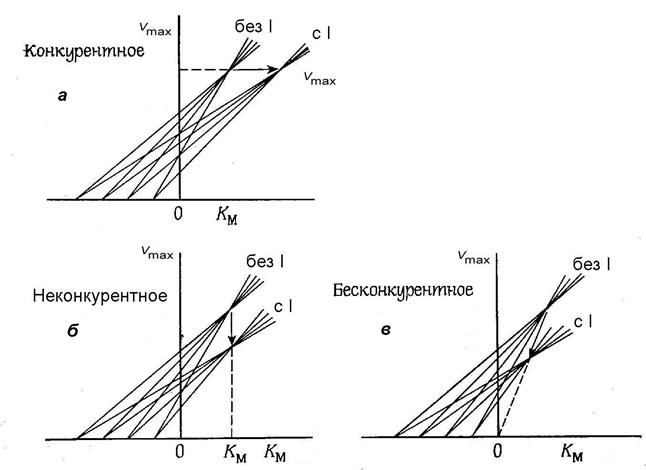
Рис. 7. Зависимость максимальной скорости реакции от константы Михаэлиса в координатах Эйзенталя и Корниш-Боудена при различных типах ингибирования: а - конкурентное ингибирование; б - неконкурентное ингибирование; в - бесконкурентное ингибирование
Записав уравнение материального баланса для фермента и подставив в него выраженные через Ki концентрации [EI] и [ESI], мы получаем
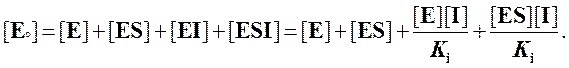
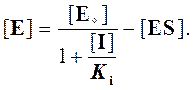 Выражаем отсюда [E]:
Выражаем отсюда [E]:
Записываем условие квазистационарного состояния и подставляем в него [E]:
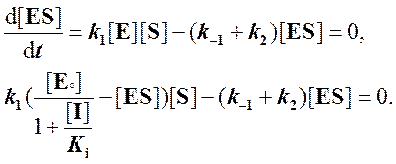
Решаем относительно [ES]:
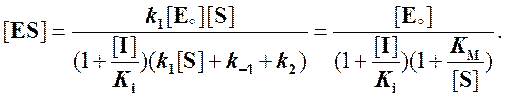
Тогда скорость реакции:
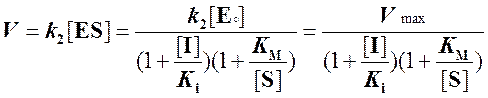 . (6)
. (6)
Из выражения (6)
видно, что при неконкурентном ингибировании ферментативной реакции константа
Михаэлиса не изменяется, но максимальная скорость реакции уменьшается в 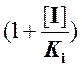 раз. Если концентрация ингибитора
становится бесконечно большой, то скорость реакции стремится к нулю. Отсюда
можно сделать вывод, что действие неконкурентного ингибитора нельзя устранить
путем увеличения концентрации субстрата.
раз. Если концентрация ингибитора
становится бесконечно большой, то скорость реакции стремится к нулю. Отсюда
можно сделать вывод, что действие неконкурентного ингибитора нельзя устранить
путем увеличения концентрации субстрата.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.