На рис. 8 представлены графики зависимости скорости ферментативной реакции от концентрации субстрата в отсутствие и в присутствии неконкурентного ингибитора в координатах Лайнуивера - Берка.
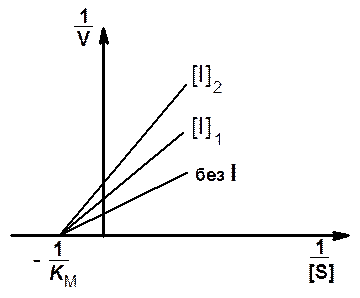
Рис. 8. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии неконкурентного ингибитора в координатах Лайнуивера - Бэрка
Из графика Лайнуивера
- Бэрка (рис. 8)
видно, что при неконкурентном ингибировании прямые пересекаются в точке,
лежащей на оси абсцисс. Численное значение абсциссы этой точки равно обратной
величине константы Михаэлиса. Точки пересечения прямых с осью ординат дают
обратные величины максимальных скоростей реакции (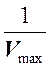 и
и 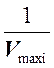 ) в отсутствие и в присутствии
неконкурентного ингибитора.
) в отсутствие и в присутствии
неконкурентного ингибитора.
Определив значения максимальных скоростей реакции графически, мы можем рассчитать Ki:
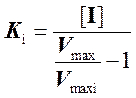 .
.
График Иди - Хофсти для неконкурентного ингибирования приведен на рис. 9. Из этого графика видно, что прямые, полученные в отсутствие и в присутствии ингибитора, являются параллельными. При этом угол наклона прямых остается постоянным, т. е. константа Михаэлиса не изменяется, изменяются отрезки, отсекаемые на оси ординат, т. е. при неконкурентном ингибировании наблюдается уменьшение максимальной скорости реакции.
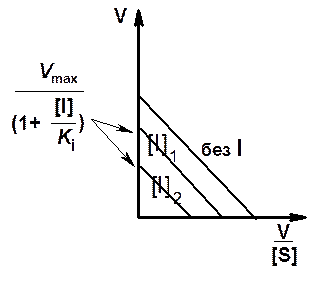
Рис. 9. Зависимость скорости ферментативной реакции от концентрации субстрата в отсутствие и в присутствии неконкурентного ингибитора в координатах Иди - Хофсти
.
Таким образом, легко можно отличить конкурентное ингибирование от неконкурентного по пересечению прямых на графиках Лайнуивера - Бэрка (ср. рис. 5 и 8) или на графиках Иди - Хофсти (рис. 6 и 9).
Как видно из рис. 7, б, в координатах Эйзенталя и Корниш-Боудена при неконкурентном ингибировании точка пересечения прямых, построенных в координатах КM; Vmax, смещается вниз. При этом ее абсцисса остается постоянной и равной КM, а изменяется ордината, численно равная Vmax в отсутствие ингибитора или VmaxI в его присутствии (мы наблюдаем уменьшение максимальной скорости ферментативной реакции в случае ингибирования).
Следует отметить, что чистое неконкурентное ингибирование встречается довольно редко. Гораздо чаще наблюдается смешанное ингибирование, когда ингибитор увеличивает константу Михаэлиса и уменьшает максимальную скорость реакции. Это означает, что ингибитор действует и на участок связывания субстрата, и на каталитический центр.
3. Бесконкурентное ингибирование
В редких случаях степень ингибирования активности фермента может увеличиваться с повышением концентрации субстрата. Для этого типа ингибирования был предложен довольно неточный термин «бесконкурентное ингибирование». Характеристикой такого типа ингибирования является то, что ингибитор не способен присоединяться к свободному ферменту, но может присоединяться к фермент-субстратному комплексу ES с образованием неактивного или медленно реагирующего тройного комплекса ESI.
Для бесконкурентного ингибирования схема реакции записывается в виде
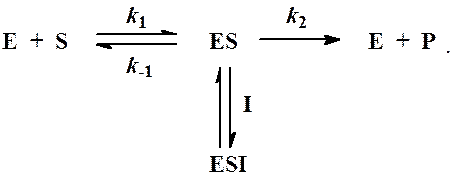
Запишем уравнение материального баланса для фермента, подставив в него выраженную из Ki величину [ESI]:
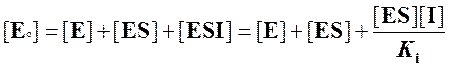 ,
,
откуда
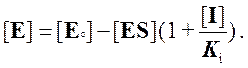
Записываем условие квазистационарного состояния:
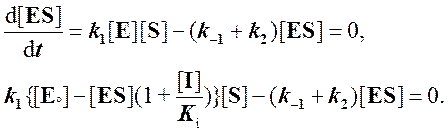
Решаем относительно [ES]:
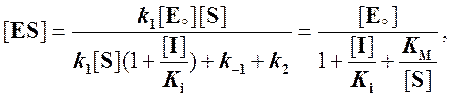
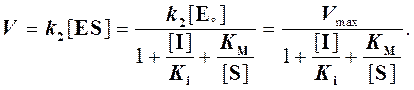
Тогда скорость реакции
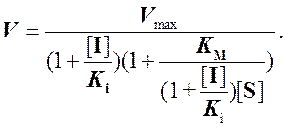 (7)
(7)
При бесконкурентном ингибировании из выражения (7) следует, что в одинаковой мере уменьшается как константа Михаэлиса, так и максимальная скорость реакции.
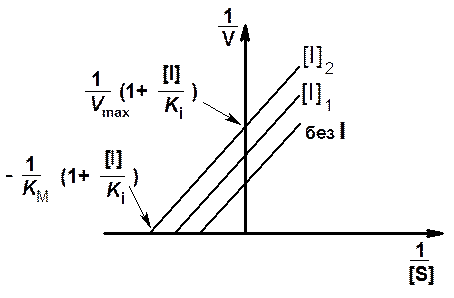
Рис. 10. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии бесконкурентного ингибитора в координатах Лайнуивера - Бэрка
Графики двойных обратных величин для таких систем являются прямыми, параллельными прямой, полученной в отсутствие ингибитора (рис. 10).
В координатах Иди - Хофсти (рис. 11) прямые, полученные
в отсутствие и в присутствии бесконкурентного ингибитора, пересекаются в точке,
лежащей на оси абсцисс. Это связано с тем, что Vmax и КM уменьшились в
одинаковое количество раз, а численное значение абсциссы этой точки равно 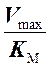 .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.