Электронная
конфигурация стабильного атома углерода ![]() предполагает
наличие двух неспаренных р электронов, т.е. валентность 2, что подтверждается
наличием молекулы
предполагает
наличие двух неспаренных р электронов, т.е. валентность 2, что подтверждается
наличием молекулы ![]() . Однако, хорошо известны молекулы
углерода (
. Однако, хорошо известны молекулы
углерода (![]() ), где валентность равна четырем. Можно
предположить (как показано в таблице 10), что подобная валентность является
просто результатом возбуждения одного электрона, то есть возникновением электронной
конфигурации
), где валентность равна четырем. Можно
предположить (как показано в таблице 10), что подобная валентность является
просто результатом возбуждения одного электрона, то есть возникновением электронной
конфигурации ![]() . Энергетических противоречий нет. Затраты
энергии на возбуждение электрона с лихвой компенсируются наличием четырех
связей, сопровождающихся выделением энергии. Противоречие связано с конфигурацией
молекулы. Одна s-орбиталь и три
. Энергетических противоречий нет. Затраты
энергии на возбуждение электрона с лихвой компенсируются наличием четырех
связей, сопровождающихся выделением энергии. Противоречие связано с конфигурацией
молекулы. Одна s-орбиталь и три ![]() -орбитали
не могут создать четыре равноценные, энергетически одинаковой прочности связи,
образующие фигуру формы тетраэдра.
-орбитали
не могут создать четыре равноценные, энергетически одинаковой прочности связи,
образующие фигуру формы тетраэдра.
Точно с такими же трудностями можно встретиться при рассмотрении валентности бериллия, бора (см. табл. 10) и т.д.
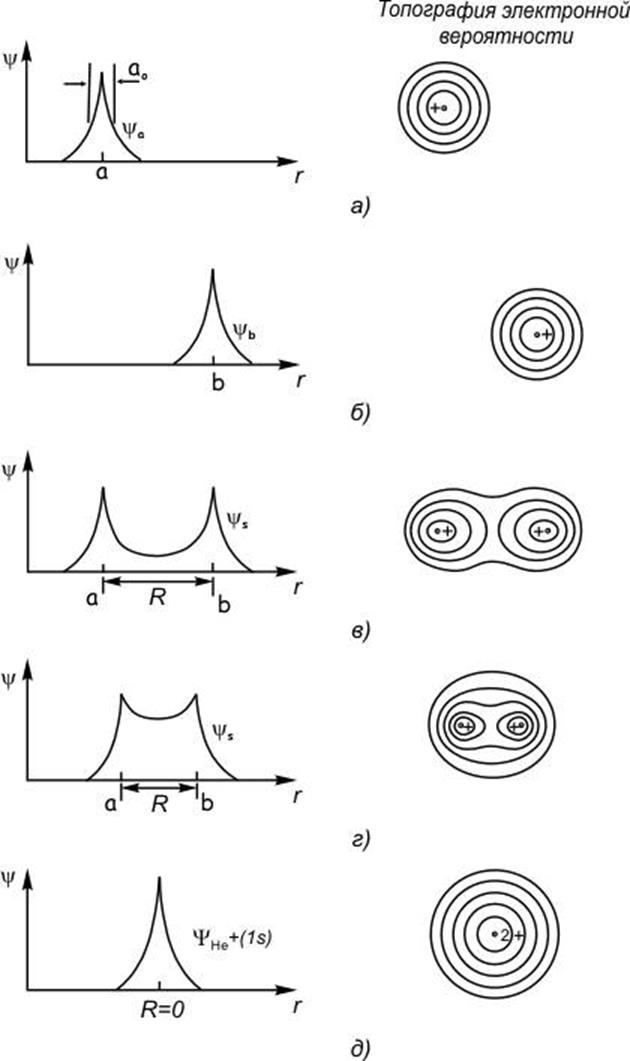
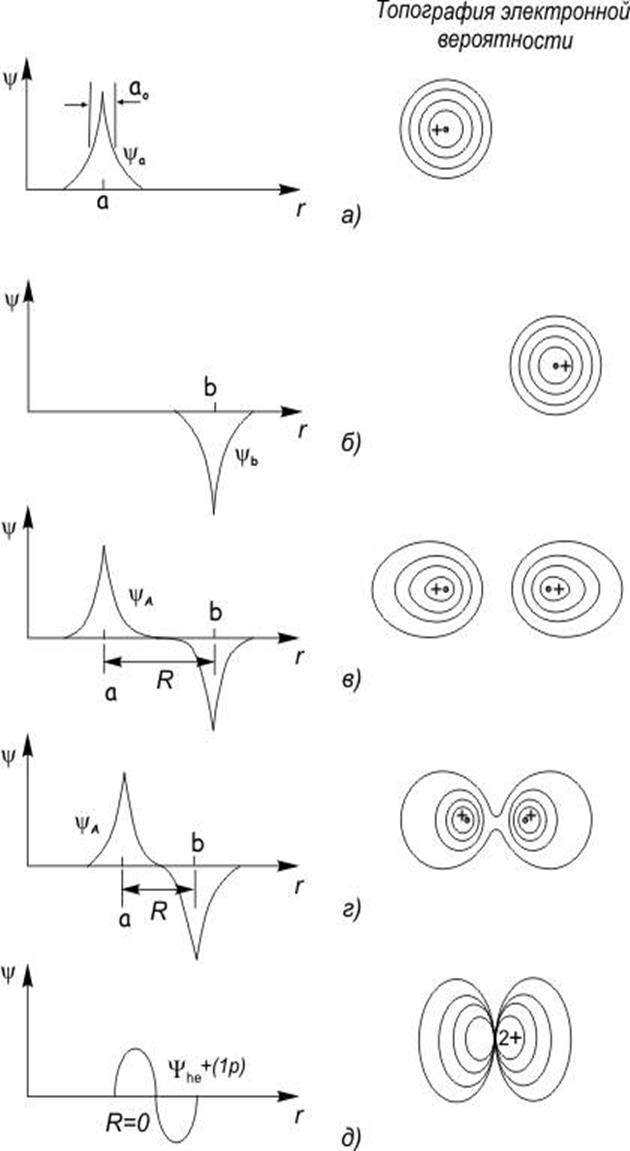
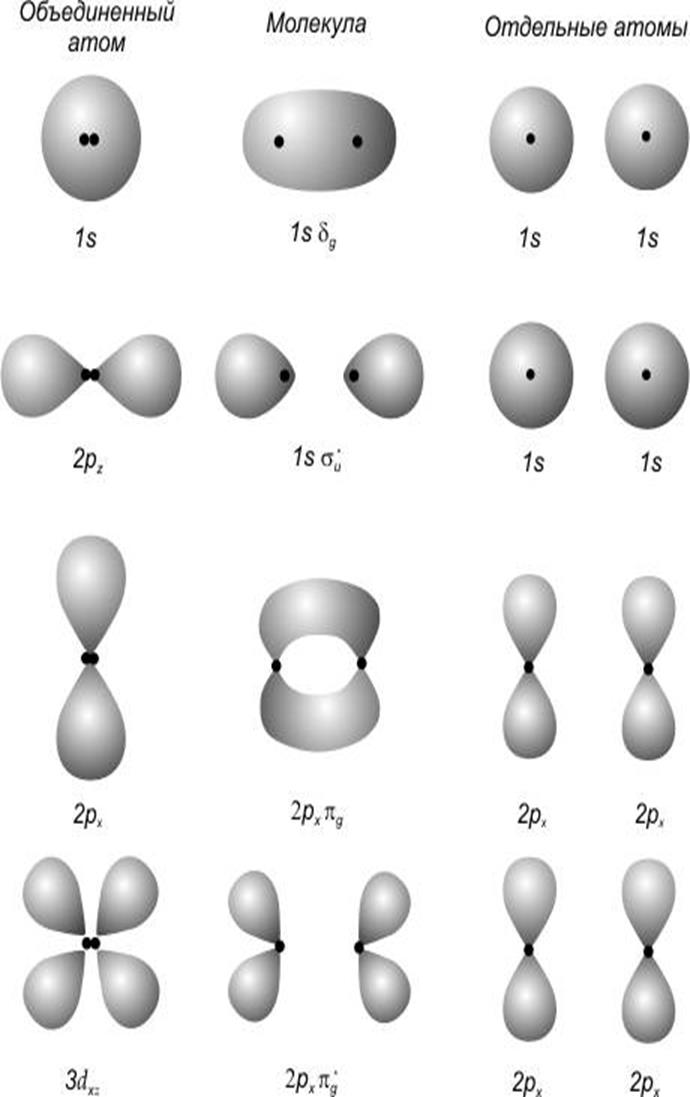
Как было показано [6], состояние любой системы может быть представлено как суперпозиция собственных функций (если они ортогональны и нормированы). В нашем случае можно рассмотреть состояние атома углерода как линейную комбинацию
![]() (70)
(70)
где i = 1,2,3,4,
то есть должно быть получено четыре новых состояния ![]() .
Критерием выбора
.
Критерием выбора ![]() является максимальная, по модулю,
энергия связи в молекуле.
является максимальная, по модулю,
энергия связи в молекуле.
|


|

|

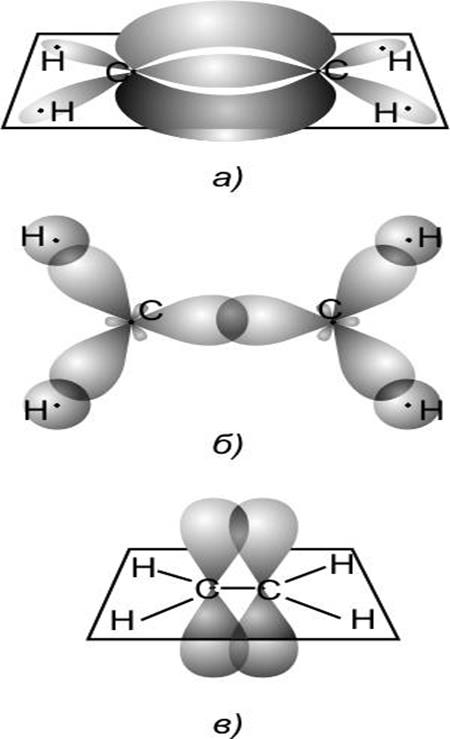
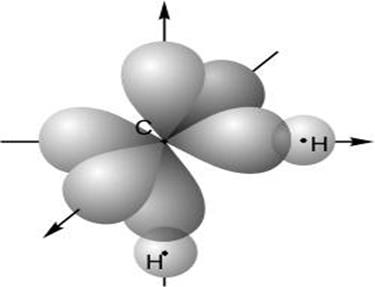
Рис. 22.
Молекула этилена ![]() (а). Все атомы лежат в плоскости
(а). Все атомы лежат в плоскости
перпендикулярной плоскости рисунка. Вид сверху, пока-
зывающий
гибридные ![]() -орбитали, образующие
-орбитали, образующие ![]() -связи
-связи
между атомами С, а также между каждым атомом С и
двумя атомами Н(б). Вид сбоку показывающий чистые
![]() -орбитали, обра зующие
-орбитали, обра зующие ![]() -связь между атомами С(в).
-связь между атомами С(в).
Коэффициенты могут быть определены
из условия нормировки и ортогональности: ![]() или
или
![]() ,
,
![]() .
.
Выберем направление одной из
связи ![]() вдоль оси Х. Тогда
вдоль оси Х. Тогда ![]() и
и ![]() в этом
направлении равны нулю и мы получим
в этом
направлении равны нулю и мы получим
![]() (71)
(71)
и ![]() ,
,
окончательно
![]() .
(72)
.
(72)
В ![]() входят
как радиальные, так и угловые волновые функции. Предположим, в нулевом
приближении, что радиальные части собственных функций (69) при заданном n идентичны,
то есть не зависят от
входят
как радиальные, так и угловые волновые функции. Предположим, в нулевом
приближении, что радиальные части собственных функций (69) при заданном n идентичны,
то есть не зависят от ![]() , тогда сферическую часть (69)
можно отнормировать на
, тогда сферическую часть (69)
можно отнормировать на ![]() и переписать в виде
и переписать в виде
![]() ,
,
![]() ,
,
![]() ,
(73)
,
(73)
![]() .
.
Тогда
выражение (72) с учетом (73) в направлении оси связи X (![]() равно
равно
![]() . (74)
. (74)
Значение а1
должно быть таким, чтобы ![]() имело наибольшую величину.
Из
имело наибольшую величину.
Из ![]() находим а1 = 1/2
и из (71) b1 =
находим а1 = 1/2
и из (71) b1 = ![]() /2,
следовательно
/2,
следовательно
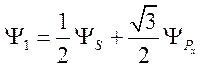 . (75)
. (75)
Предположим,
что вторая линия связи расположена в плоскости xz, в которой ![]() , тогда
, тогда
![]() , (76)
, (76)
![]() , (77)
, (77)
![]() . (78)
. (78)
Тогда из (75,77,78) находим ![]() , следовательно
, следовательно
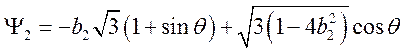 .
.
Здесь учтено, что ![]() . Из
. Из 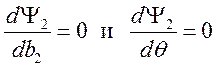 находим
находим
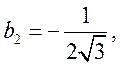
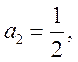
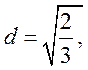
![]() . Окончательно имеем
. Окончательно имеем
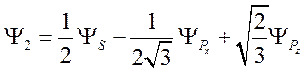 (79)
(79)
и угол между первой и второй
гибридной связью ![]() , равный тетраэдрическому углу.
, равный тетраэдрическому углу.
Аналогичным образом можно получить
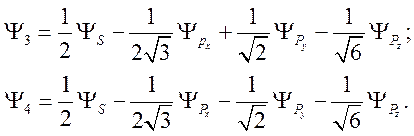 80)
80)
Все эти
функции отличаются друг от друга только поворотом на тетраэдрический угол ![]() .
.
Итак, линейная
комбинация (гибридизация) ![]() собственных функций
приводит к образованию тетраэдрически ориентированных собственных функций,
которые могут обеспечить четыре одинаковых связи. Наиболее ярко подобная связь
проявляется в алмазе.
собственных функций
приводит к образованию тетраэдрически ориентированных собственных функций,
которые могут обеспечить четыре одинаковых связи. Наиболее ярко подобная связь
проявляется в алмазе.
При sp-гибридизации
кроме образования тетраэдрических связей, есть большая вероятность образования
тригональных связывающих собственных функций, образующих на плоскости между собой
углы ![]() .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.