2.5. Структура молекул. Гибридизация
Решение уравнения Шредингера для водородоподобных атомов имеет вид
![]() (66)
(66)
где ![]() —
радиальная волновая функция и
—
радиальная волновая функция и ![]() — собственные функции
оператора момента и его проекции.
— собственные функции
оператора момента и его проекции.
Величина ![]() определяется уравнением
определяется уравнением
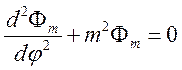 ,
(67)
,
(67)
решение которого обычно записывается в виде
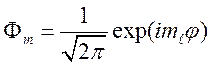 , (68)
, (68)
где ![]() .
.
Очевидно, что
решением уравнения (67) является также линейная комбинация ![]() типа (68)
типа (68)
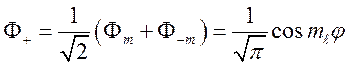 ,
,
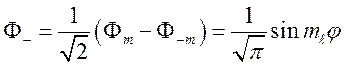 ,
,
где ![]()
Для n = 2,
![]() = 1 и 0 и
= 1 и 0 и ![]() значения
значения ![]() могут
быть записаны в форме
могут
быть записаны в форме
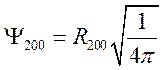 ,
,
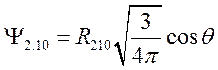 , (69)
, (69)
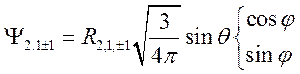 .
.
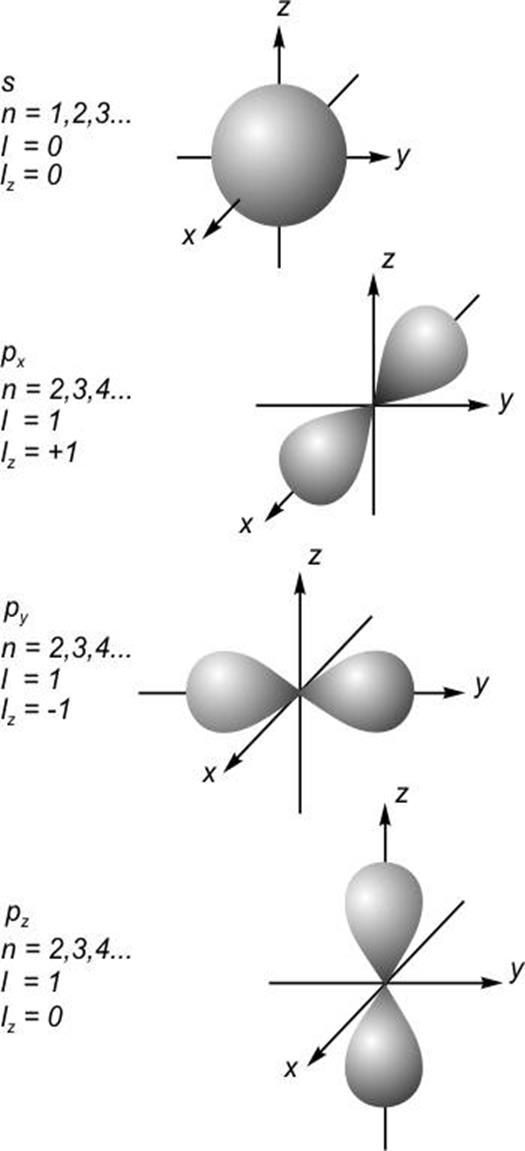
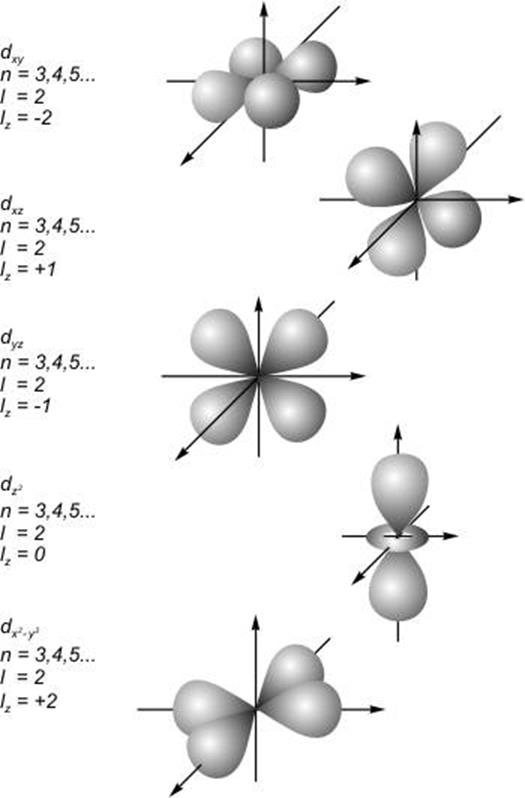
Распределения
плотности вероятности обнаружения электрона показаны на рис. 16-17
(показаны поверхности, внутри которых можно найти электрон с вероятностью 95%).
В s - состоянии форма электронного облака сферически
симметрична. Как видно, распределения электронного облака при ![]() имеют форму восьмерок, вытянутых вдоль
осей x, y, z. Эти состояния обычно называют
имеют форму восьмерок, вытянутых вдоль
осей x, y, z. Эти состояния обычно называют ![]() -,
-, ![]() -,
-, ![]() - атомными e орбиталями. Форма d - орбиталей
показана на рис. 17.
- атомными e орбиталями. Форма d - орбиталей
показана на рис. 17.

|

Как мы уже
отмечали ранее (см. раздел 2.4 и рис. 15), для оценки энергии связи можно
проследить изменение энергии системы в зависимости от расстояния между атомами,
образующими молекулу. Известна энергия в двух предельных случаях: отдельно двух
атомов (![]() ) и объединенного атома (
) и объединенного атома (![]() ). В случае водорода в качестве
объединенного атома выступает гелий.
). В случае водорода в качестве
объединенного атома выступает гелий.
На рис.
18, 19 показано изменение двух 1s-волновых функций атома водорода
при сближении атомов. Рассмотрены симметричная и антисимметричная комбинации ![]() и
и ![]() ,
приводящие к образования S и Р состояний объединенного атома. На
рис. 20 представлены распределения плотности вероятности в атоме Н, молекуле
,
приводящие к образования S и Р состояний объединенного атома. На
рис. 20 представлены распределения плотности вероятности в атоме Н, молекуле ![]() и объединенном атоме Не. Из приведенных
рисунков наглядно видно каким образом происходит образование связывающих и
разрыхляющих молекулярных орбиталей.
и объединенном атоме Не. Из приведенных
рисунков наглядно видно каким образом происходит образование связывающих и
разрыхляющих молекулярных орбиталей.
Геометрическое
строение многоатомных молекул легко понять, если привлечь понятия атомных
орбиталей. Рассмотрим для примера молекулу воды ![]() .
Учитывая электроотрицательные свойства кислорода, можно было бы предположить,
что водород отдает электроны кислороду и образуется линейная молекула
.
Учитывая электроотрицательные свойства кислорода, можно было бы предположить,
что водород отдает электроны кислороду и образуется линейная молекула ![]() . Однако, реальный угол между связями Н - О
оказывается близок к
. Однако, реальный угол между связями Н - О
оказывается близок к ![]() . Действительно, в атоме О
имеются две орбитали
. Действительно, в атоме О
имеются две орбитали ![]() и
и ![]() с одним
электроном в каждой. Могут возникнуть
с одним
электроном в каждой. Могут возникнуть ![]() и
и ![]() орбитали (см. рис. 21), угол между осями
которых и составит
орбитали (см. рис. 21), угол между осями
которых и составит ![]() . Значение угла
. Значение угла ![]() (больше
(больше ![]() )
обусловлено отталкиванием протонов. В данном случае рассматривается проекция
момента на ось, связывающую два атома Н и О, то есть сложная молекула
разбивается на отдельные связи между двумя атомами. Структура сложной молекулы
показана на рис. 22 (
)
обусловлено отталкиванием протонов. В данном случае рассматривается проекция
момента на ось, связывающую два атома Н и О, то есть сложная молекула
разбивается на отдельные связи между двумя атомами. Структура сложной молекулы
показана на рис. 22 (![]() ).
).
Аналогичные
рассуждения позволяют легко понять пирамидальную структуру аммиака ![]() . В азоте имеется три одиночных
электрона на
. В азоте имеется три одиночных
электрона на ![]() -,
-, ![]() -,
-, ![]() -орбиталях, которые, аналогично, образуют
три ортогональных молекулярных орбитали
-орбиталях, которые, аналогично, образуют
три ортогональных молекулярных орбитали ![]() .
.
Необходимо
отметить, что рассмотренная идеальная картина работает не всегда. В частности,
атом углерода имеет конфигурации ![]() и можно было бы
предположить, что гидрид углерода будет иметь формулу
и можно было бы
предположить, что гидрид углерода будет иметь формулу ![]() с
двумя связывающими sp
с
двумя связывающими sp![]() орбиталями. Однако,
реально мы имеем
орбиталями. Однако,
реально мы имеем ![]() . Возникновение четырех орбиталей
обусловлено процессом гибридизации. Каждая орбиталь является объединением s- и p-орбиталей.
Подобный процесс оправдан, если конечная молекула за счет большого числа связей
будет иметь суммарную энергию меньшую, чем исходные атомы.
. Возникновение четырех орбиталей
обусловлено процессом гибридизации. Каждая орбиталь является объединением s- и p-орбиталей.
Подобный процесс оправдан, если конечная молекула за счет большого числа связей
будет иметь суммарную энергию меньшую, чем исходные атомы.
Остановимся на проблеме гибридизации, в силу ее важности, более подробно.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.