Константа
кислотности одноосновной кислоты задаётся уравнением 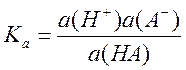 (3).
Для диссоциации кислоты в водном растворе данное уравнение можно преобразовать
к виду (4)
(3).
Для диссоциации кислоты в водном растворе данное уравнение можно преобразовать
к виду (4)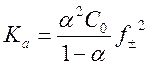 , где α – степень диссоциации кислоты, а f± - средний ионный коэффициент активности.
, где α – степень диссоциации кислоты, а f± - средний ионный коэффициент активности.
Далее поступают
так. Оптическая плотность раствора определяется только поглощением аниона А-
и молекулами кислоты НА. Тогда ![]() (5).
(5).
Оптическая плотность является функцией степени диссоциации кислоты и зависит от pH среды. Добавив к раствору исследуемой кислоты сильную кислоту, получим спектр поглощения недиссоциированных молекул кислоты НА. При добавлении щёлочи можно получить спектр поглощения аниона А-.
Получим значения для молярных
коэффициентов экстинкции: 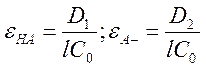 (6). Тогда степень
диссоциации кислоты можно определить по формуле
(6). Тогда степень
диссоциации кислоты можно определить по формуле 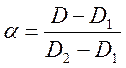 (7).
(7).
Хорошие
результаты определения константы кислотности получают для буферных растворов с
известными значениями pH. При этом ликвидируется
ошибка, связанная с наличием в растворе какого-либо конкурирующего равновесия с
участием протонов, которое могло бы повлиять на точное значение pH раствора. Для расчёта Ka
используют формулу: 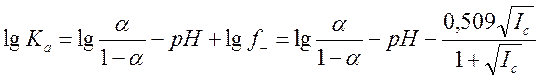 (8). Величина Ic – ионная сила раствора, рассчитываемая как (9)
(8). Величина Ic – ионная сила раствора, рассчитываемая как (9)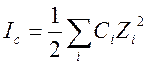 . Ci – концентрация в растворе иона i,
а Zi – заряд этого иона.
. Ci – концентрация в растворе иона i,
а Zi – заряд этого иона.
Экспериментальная часть.
В данной работе исследуется кислотно-основное равновесие, устанавливающееся в растворах метилового оранжевого (натриевой соли 4’-диметиламиноазабензол-4-сульфокислоты).
Схематично процесс диссоциации, протекающий в растворе данного индикатора, можно представить следующим уравнением:
В работе используются следующие растворы:
|
Растворенное вещество |
Концентрация |
|
Метиловый оранжевый |
1 г/л |
|
HCl |
0,1 M |
|
NaOH |
0,1 M |
|
CH3COOH |
0,3 M |
|
Номер раствора |
Раствор метилового оранжевого 0,2 г/л |
Раствор кислоты или щелочи 0,1 г/л |
|
1 |
2,0 мл |
5 мл HCl |
|
2 |
1,5 мл |
5 мл HCl |
|
3 |
1,0 мл |
5 мл HCl |
|
4 |
0,5 мл |
5 мл HCl |
|
5 |
2,5 мл |
5 мл NaOH |
|
6 |
2,0 мл |
5 мл NaOH |
|
7 |
1,5 мл |
5 мл NaOH |
|
8 |
1,0 мл |
5 мл NaOH |
|
9 |
2,0 мл |
25 мл буфера 1 |
|
10 |
2,0 мл |
25 мл буфера 2 |
|
11 |
2,0 мл |
25 мл буфера 3 |
В данной работе исследуется кислотно-основное равновесие, устанавливающееся в растворах метилового оранжевого.
V=200мл; C(NaOAc)=0,02М; Мr(NaOAc*3H2O)=136,08г/моль;
m(NaOAc)=M*C*V=0,5443г. (нужно взять), mнавески=0,5447г.
СН3СООН→СН3СОО-+Н+;
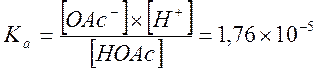
Концентрация HOAc рассчитывается по формуле:
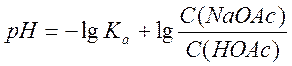
С(HOAc)=0,1439M
У нас готовый раствор 0,3 М HOAс тогда необходимый объем: V(HOAc)=0,1439*0,2*1000/0,3=95,93 мл
Буферные растворы готовят на откалиброванном ионометре «Анион-4100». Корректируют значение рН приготовленного буфера 1, добавляя в него ацетат натрия или уксусную кислоту.
буфер 2 - pH=3,7
буфер 3 - рН=3,5
Спектры поглощения приготовленных растворов индикатора снимают в области 300-600 нм. Для этого используют кюветы с длиной оптического пути l =1 см. В качестве раствора сравнения или раствора для корректировки базовой линии используют дистиллированную воду.
a. Снимают спектры поглощения растворов № 1, 6, 9-11. Определяют рабочие длины волн (λ1 и λ2) для каждой формы индикатора и поглощение Dλi. Находят изобестическую точку, определяют ее характеристики (λ=468 нм, ε=0,64 М-1×см-1)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.