НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Задача С – 2
Определение константы диссоциации метилового оранжевого по спектроскопическим данным.
Выполнили:
Сидорова Христина,
Симонова Ольга
группа 9402
Новосибирск, 2011г
ВВЕДЕНИЕ
Спектроскопия используется для идентификации химических соединений и для определения концентрации веществ в растворах или смесях. Спектроскопия позволяет также изучать строение и энергетические свойства молекул, исследовать равновесия, кинетику химических реакций и т.д. Объектами для исследования могут являться вещества в любом агрегатном состоянии.
Любые изменения энергии системы связаны с её скачкообразным переходом из одного состояния в другое. Если при этом переходе вещество поглощает или испускает электромагнитное излучение, то подобные переходы называются излучательными, или радиационными и могут быть изучены посредством спектроскопического анализа.
Поглощение
кванта электромагнитной энергии приводит к тому, что система переходит в
состояние с большей энергией. По формуле Планка величина кванта поглощённой
энергии определяется разностью энергий начального и конечного состояний
системы: 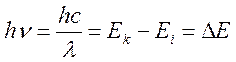 . Заметим, что в ряде случаев, явление носит
более сложный характер и может сопровождаться одновременным поглощением двух
квантов энергии. Излучение характеризуют энергией, интенсивностью, а также
волновыми параметрами – длиной волны, частотой или волновым числом. В настоящее
время принята следующая классификация областей электромагнитного излучения.
. Заметим, что в ряде случаев, явление носит
более сложный характер и может сопровождаться одновременным поглощением двух
квантов энергии. Излучение характеризуют энергией, интенсивностью, а также
волновыми параметрами – длиной волны, частотой или волновым числом. В настоящее
время принята следующая классификация областей электромагнитного излучения.
|
Область спектра |
Спектральные характеристики |
|
|
Длина волны, нм |
Волновое число, см-1 |
|
|
Вакуумный УФ |
10 – 200 |
5*104 – 106 |
|
УФ |
200 – 380 |
2,5*104 – 5*104 |
|
Видимый свет |
380 – 750 |
1,3*104 – 2,5*104 |
|
Ближняя ИК |
750 – 25000 |
400 –1,3*104 |
|
Далёкая ИК |
2,5*104 – 106 |
10 – 400 |
Абсорбционная спектроскопия исследует поглощательную способность химических веществ. При рассмотрении электронного строения органических молекул выделяют следующие типы молекулярных орбиталей: σ, σ*, π, π* и n. Орбитали σ и σ* присутствуют в любых органических молекулах, π и π* - в молекулах с кратными связями, а n – орбитали характерны для соединений, в составе которых присутствует гетероатом с неподелённой парой электронов. При оптическом возбуждении могут реализоваться следующие типы переходов: σ→σ*, π→π*, n→σ* и n→π*.
Переходы на σ* орбитали лежат в области вакуумного УФ и обычно наблюдаются для предельных углеводородов и их галогенпроизводных, а также карбонильных соединений. Переходы на π* орбитали относятся к области ближнего УФ или видимого света. Чем больше в молекуле взаимодействующих π-электронов, тем меньше энергия основного состояния такой молекулы и тем меньше величина кванта энергии, необходимого для возбуждения молекулы. Взаимодействие π-электронов увеличивает число возможных энергетических состояний молекулы.
В молекулах органических соединений встречаются группы атомов, которые “ответственны” за окраску соединения. Это могут быть полярные группы или группы атомов с кратными связями, поглощающие излучение в ближнем УФ диапазоне или видимой области. Такие группы атомов называют хромофорами. Другие группы атомов могут увеличивать интенсивность окраски вещества, усиливая поглощение других групп. Эти группы атомов называют ауксохромными. В качестве примера хромофоров можно указать карбонильную группу, фенильный радикал, нитрогруппу, а ауксохромными являются метокси-группа, аминогруппа, гидрокси-группа и многие другие.
ОПТИЧЕСКАЯ ПЛОТНОСТЬ И ЗАКОН БУГЕРА-ЛАМБЕРТА-БЭРА.
Способность вещества
поглощать свет от внешнего источника называют оптической плотностью. Эта
величина есть мера непрозрачности вещества. Количественно оптическую плотность
определяют как десятичный логарифм отношения интенсивности излучения, падающего
на слой вещества к интенсивности излучения, прошедшего сквозь слой вещества. 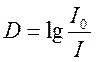 . Зависимость оптической плотности от длины
волны λ называют спектром поглощения данного соединения.
. Зависимость оптической плотности от длины
волны λ называют спектром поглощения данного соединения.
В основе всех количественных измерений в спектроскопии лежит закон Бугера-Ламберта-Бэра. Он устанавливает зависимость способности вещества к поглощению от концентрации вещества в растворе. В настоящее время этот закон нашёл широкое применение в области биологической химии и молекулярной биологии, так как большинство биологических объектов поглощают в ближней УФ области и их концентрации часто чересчур малы для идентификации химическими методами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.