2. Трет-бутилхлорид.
Порядок проведения работы
К 30 мл водно-спиртового раствора определенного состава добавляли одну каплю трет-бутилхлорида и быстро перемешивали. При помощи шприца, быстро заполняли ячейку кондуктометра этой смесью, стараясь избегать пузырей. На кондуктометре включали режим записи в блокнот с интервалом времени 10 – 45 с (в зависимости от состава водно-спиртового раствора) и по окончании эксперимента получали 99 значений электропроводности от времени.
Методы расчета констант скоростей
Расчет константы скорости проводили из предположения, что реакция сольволиза трет-бутилхлорида проходит по механизму SN1:
(CH3)3CCl + H2O → (СH3)3COH + HCl,
Следовательно, реакция имеет первый порядок по
трет-бутилхлориду: 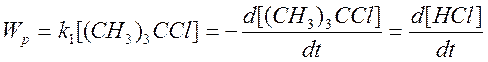 (2)
(2)
В условиях опыта электропроводность раствора χ
пропорциональна концентрации образующейся соляной кислоты [HCl]:
![]() , (3)
, (3)
где A=const.
Пусть χ∞ – конечная
электропроводность раствора (при полном гидролизе (CH3)3CCl, т.е. ![]() , где C0 – начальная концентрация трет-бутилхлорида).
Тогда:
, где C0 – начальная концентрация трет-бутилхлорида).
Тогда:
![]() (4)
(4)
Подставляя в (2), уравнения (3) и (4), учитывая
также, что ![]() , можно получить следующее кинетическое
уравнение для электропроводности исследуемого раствора:
, можно получить следующее кинетическое
уравнение для электропроводности исследуемого раствора:
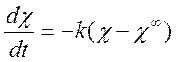
После интегрирования имеем:
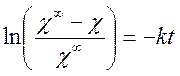 или
или
![]() .
.
Таким образом, зная зависимость электропроводности χ от времени, можно определить величину константы скорости k.
Полученные данные обрабатывали средствами программы «Origin 7.5 Pro». Было использовано 3 метода обработки:
1.
Метод аппроксимации данных избранной функцией. При такой обработке
использовались, полученные в результате экспериментов, зависимости
электропроводностей растворов от времени χ(t).
В качестве функции для аппроксимации была выбрана экспоненциальная зависимость
вида![]() . Где k –
константа скорости реакции сольволиза трет-бутилхлорида, А – электропроводность
раствора после завершения химической реакции (χ∞).
Зависимости χ(t) а также результаты
математической обработки приведены на рис. 1-8.
. Где k –
константа скорости реакции сольволиза трет-бутилхлорида, А – электропроводность
раствора после завершения химической реакции (χ∞).
Зависимости χ(t) а также результаты
математической обработки приведены на рис. 1-8.
2.
Интегральный метод. Заключался в получении анаморфозы,
соответствующей кинетике первого порядка. Для этого строили графики зависимости
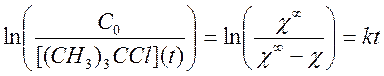 от
времени. Величина χ∞ была взята из расчетов по методу 1. Константу
скорости реакции находили, как начальный тангенс угла наклона получившихся
прямых. Все полученные графики приведены на рис. 9, причем четко прослеживается
снижение константы скорости при уменьшении диэлектрической проницаемости, что
соответствует уравнению (1), предложенному для описания
поведения данной системы.
от
времени. Величина χ∞ была взята из расчетов по методу 1. Константу
скорости реакции находили, как начальный тангенс угла наклона получившихся
прямых. Все полученные графики приведены на рис. 9, причем четко прослеживается
снижение константы скорости при уменьшении диэлектрической проницаемости, что
соответствует уравнению (1), предложенному для описания
поведения данной системы.
3.
Дифференциальный метод. В данном методе применяли уравнение зависимости
скорости реакции от концентрации 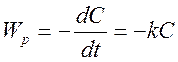 , которое можно
представить, как
, которое можно
представить, как 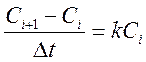 . Здесь Сi+1 и Ci
– соседние точки по кинетической кривой, Δt – интервал времени между
точками. Поэтому для нахождения константы скорости реакции строили графики
зависимости величин
. Здесь Сi+1 и Ci
– соседние точки по кинетической кривой, Δt – интервал времени между
точками. Поэтому для нахождения константы скорости реакции строили графики
зависимости величин 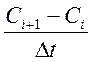 от Сi , методом МНК проводили
аппроксимирующие прямые, тангенсы угла наклона которых являлись константами
скорости реакции k. Зависимости
от Сi , методом МНК проводили
аппроксимирующие прямые, тангенсы угла наклона которых являлись константами
скорости реакции k. Зависимости 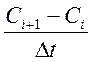 от Сi
а также результаты математической обработки приведены на рис. 10-18.
от Сi
а также результаты математической обработки приведены на рис. 10-18.
Определение зависимости констант скоростей от диэлектрической проницаемости среды.
Диэлектрические проницаемости водно-спиртовых растворов находили по формуле:
![]() ,
,
где xi – мольная доля компонента в растворе.
Диэлектрические проницаемости растворов, экспериментальные константы скорости реакций, а также некоторые соответствующие им литературные значения [6] приведены в табл. 1.
Табл. 1. Литературные и рассчитанные различными методами константы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.