Спектрометр предусматривает возможность варьирования температурных условий за счёт температурной приставки. Это позволяет отслеживать изменения в качественном и количественном составе анализируемой смеси в зависимости от её температуры. Нагрев осуществляется воздушной смесью, нагнетаемой компрессором от нагревателя к образцу.
Определение величин изменения энтропии и энтальпии для процесса кето-енольной таутомерии ацетилацетона.
Кето-енольная таутомерия.
Явление
кето-енольной таутомерии связано с взаимодействием атома кислорода карбонильной
группы с протоном соседней группы (CH, CH2
или CH3). При реализации этого
взаимодействия атом кислорода предоставляет по донорно-акцепторному механизму
неподелённую электронную пару для протона. Ослабляется взаимодействие между
атомом кислорода и карбонильным атомом – и в пределе протон мигрирует к атому
кислорода, а образовавшийся отрицательный заряд на атоме углерода
взаимодействует с наиболее электроположительным карбонильным атомом углерода,
образуя π-связь. Двойная связь между кислородом и карбонильным углеродом при
этом разрывается. 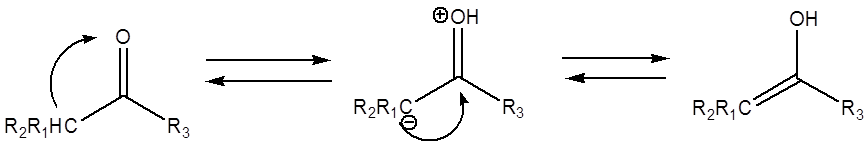
В стандартных условиях любой кетон или альдегид, для которого возможна енолизация, находится в смеси двух таутомерных форм. Более стабильной термодинамически является кетонная форма, поэтому равновесие сильно смещено в одну сторону (енол в смеси порой составляет менее 10-4 – 10-2%). Для большинства соединений процесс кето-енольной таутомерии протекает только при наличии катализатора, например, кислоты или основания. С ростом температуры содержание енольной формы возрастает. Если для соединения возможны несколько вариантов образования енола, то предпочтительно образование более замещённого енола.
Ацетилацетон, как и многие другие кетоны, может находиться в двух таутомерных формах:
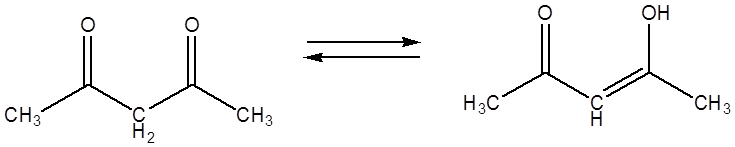
Существует, разумеется ещё 1 енол, отвечающий миграции протона метильной группы. Его образование крайне невыгодно, поэтому содержание такого енола пренебрежимо мало. Отличительной особенностью ацетилацетона является то, что енольная форма стабилизирована p-π сопряжением с соседней карбонильной группой. Сопряжение оказывается очень мощным фактором, поэтому содержание в смеси енольной формы ацетилацетона гораздо больше (до 80%), чем для обычного кетона или альдегида. Количество енола превышает количество дикетона в смеси. Причина такого нарушения закономерности лежит, по-видимому, в строении образующейся молекулы.
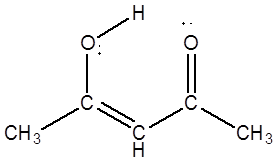
Протон гидроксильной группы по донорно-акцепторному механизму взаимодействует с карбоксильной группой. При этом образуется виртуальный шестичленный цикл, сходный с циклом бензола.
В ПМР спектре наблюдаются несколько сигналов. Кетонная форма ацетилацетона даёт в спектре 2, а енольная форма – 3 сигнала. Из интеграла спектра ЯМР оценивают относительное содержание форм в смеси. Сигнал OH-группы в условиях эксперимента получен очень слабым и размытым. Химический сдвиг CH-группы составляет 80Гц/60МГц
В данной работе изучают зависимость состава смеси таутомеров от температуры, что позволяет определить некоторые термодинамические величины, например, величин изменения энтальпии и энтропии в реакции взаимопревращения форм. Для расчёта их значений используют уравнения
∆G0T= - R*T*ln K,
∆G0T=∆H0T-T*∆S0T,
откуда
R*ln K = - ∆H0T/T+∆S0T (1).
Величина K может быть получена из спектра ЯМР как отношение площадей, соответствующих сигналам CH2 и CH групп. Пренебрегая зависимостью ∆H0Tи ∆S0T от температуры в рабочем интервале температур 298 – 365К, т.е. полагая ∆ rcp0=0, можно, отслеживая зависимость константы равновесия K от температуры получить некоторый набор точек (1/T, K). Из уравнения (1) следует, что зависимость носит линейный характер. Поэтому, используя МНК (метод наименьших квадратов) можно приблизить значения эксперимента прямой
y=k*x+b,
где k= - ∆H0T, b=∆S0T, x=1/T, а y= R*ln K. Погрешности определения рассчитывают по формулам МНК.
Экспериментальная часть
В работе был снят спектр ПМР ацетилацетона на приборе “TESLA BS-467” относительно ТМС. Температуру образца последовательно изменяли. С ростом температуры площадь сигнала, отвечающего CH2-группе, возрастает, что свидетельствует об увеличении содержания кетонной формы ацетилацетона в смеси. Это соответствует уменьшению значения константы равновесия K (см таблицу 1). Химический сдвиг CH-группы составляет 80 Гц / 60 МГц=1,33 м.д., химический сдвиг CH2-группы равен 51 Гц / 60 МГц = 0,85 м.д.
Таблица 1
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.