![]() Связь (отдельная, единичная) между атомами образуется при взаимодействии только
двух электронов с противоположными спинами, принадлежащих различным атомам.
Связь (отдельная, единичная) между атомами образуется при взаимодействии только
двух электронов с противоположными спинами, принадлежащих различным атомам.
![]() Валентность
атома - это число неспаренных электронов, которые способны создать подобную
связь.
Валентность
атома - это число неспаренных электронов, которые способны создать подобную
связь.
 Одноэлектронные молекулярные состояния
Одноэлектронные молекулярные состояния
![]() Метод самосогласованного поля Хартри – Фока, как
наиболее последовательный и высоко наглядный, является в настоящее время доминирующим
способом определения одноэлектронного приближения, весьма продуктивного для
решения многих задач, например при определении равновесной структуры молекул в
основном состоянии. Однако, последовательное изложение его применительно к
молекулам достаточно объемно и, к тому же, практически не отличается по физическим
представлениям изложенным ранее при изучении одноэлектронного приближения
многоэлектронных атомов.
Метод самосогласованного поля Хартри – Фока, как
наиболее последовательный и высоко наглядный, является в настоящее время доминирующим
способом определения одноэлектронного приближения, весьма продуктивного для
решения многих задач, например при определении равновесной структуры молекул в
основном состоянии. Однако, последовательное изложение его применительно к
молекулам достаточно объемно и, к тому же, практически не отличается по физическим
представлениям изложенным ранее при изучении одноэлектронного приближения
многоэлектронных атомов.
Воспользуемся другими традиционно используемыми приближениями.
![]() Состояние
отдельного электрона в двухатомной молекуле можно задать четырьмя
квантовыми числами:
Состояние
отдельного электрона в двухатомной молекуле можно задать четырьмя
квантовыми числами:
![]() ml , (обозначается l) проекцией орбитального момента электрона
на ось молекулы,
ml , (обозначается l) проекцией орбитального момента электрона
на ось молекулы,
|
l |
0 |
1 |
2 |
|
Символ |
|
p |
|
![]() ms = ±1/2
проекцией его спина на это направление,
ms = ±1/2
проекцией его спина на это направление,
![]() n главным квантовым числом электрона,
исходного «атома»
n главным квантовым числом электрона,
исходного «атома»
![]()
![]() орбитальным
квантовым числом электрона исходного «атома»
орбитальным
квантовым числом электрона исходного «атома»
![]() Квантовые числа n
Квантовые числа n
![]() соответствуют
состоянию электрона:
соответствуют
состоянию электрона:
► либо в одном из атомов, когда междуатомного расстояния
R → ¥ «разъединенный» атом. Состояния обозначаются ![]() (напр.:
(напр.: ![]() )
)
► либо в «объединенном» атоме, при R →0;
обозначение:![]() (напр.:
(напр.:![]() )
)
Четность![]() . Для гомоядерной молекулы состояние отдельного
электрона характеризуется свойством симметрии (инверсия): четные g
состояния
. Для гомоядерной молекулы состояние отдельного
электрона характеризуется свойством симметрии (инверсия): четные g
состояния 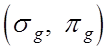 и нечетные u - состояния
и нечетные u - состояния ![]() . Четность электронного состояния
определяется четностью орбитального квантового числа l:
. Четность электронного состояния
определяется четностью орбитального квантового числа l:
![]() .
.
![]() Для гомоядерных молекул:
Для гомоядерных молекул:
к связывающим относятся следующие группы электронов (орбитали):
![]() .
.
к
разрыхляющим: ![]() - электроны.
- электроны.
У
молекул с разными ядрами разрыхляющие орбитали обычно обозначаются ![]() .
.
![]()
![]() Как и у
атома, электроны с определенным n образуют оболочку;
все электроны в ней называются эквивалентными. Электроны с определенным
Как и у
атома, электроны с определенным n образуют оболочку;
все электроны в ней называются эквивалентными. Электроны с определенным ![]() внутри оболочки
образуют подоболочку.
внутри оболочки
образуют подоболочку.
Квантовые числа однозначно определяют энергию электрона в двухатомной молекуле и ВФ (одноэлектронную орбиталь).
 Одноэлектронные состояния и термы
Одноэлектронные состояния и термы
![]() В приближении нормальной связи (Расселя-Саундерса)
проекция общего момента на ось молекулы
В приближении нормальной связи (Расселя-Саундерса)
проекция общего момента на ось молекулы
L = å l, состояние с определенной общей проекцией называется термом
|
L |
0 |
1 |
2 |
|
Символ |
å |
P |
D |
![]() Обозначения
термов на диаграммах:
Обозначения
термов на диаграммах:
· нормальное состояние - буквой X перед символом терма;
· возбужденные состояния с мультиплетностью раной мультиплетности основного состояния обозначается заглавными буквами А, В, С,...;
· возбужденные состояния другой мультиплетности - строчными буквами a, b, c.
![]() Примеры
Основные и возбужденных состояний (термов) и и соответствующих электронных
оболочек некоторых молекул (А.А.Радциг, Б.М. Смирнов, Справочник по атм. и мол.
физике, атомиздат, 1980)
Примеры
Основные и возбужденных состояний (термов) и и соответствующих электронных
оболочек некоторых молекул (А.А.Радциг, Б.М. Смирнов, Справочник по атм. и мол.
физике, атомиздат, 1980)
|
мол |
терм |
электронная конфигурация |
продукты диссоциации |
|
|
|
|
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2 |
|
|
|
|
NO |
|
|
|
|
He2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.