![]() Всего (2L2 + 1)(L1 + 1)
термов со значениями L от 0 до L1 + L2.
(учтено двукратное вырождение термов с
Всего (2L2 + 1)(L1 + 1)
термов со значениями L от 0 до L1 + L2.
(учтено двукратное вырождение термов с ![]() )
)
![]()
Спины обоих атомов складываются в полный спин молекулы:
S = S2 + S1;
S2 + S1 - 1,...![]() .
.
Комбинируя
каждое значение S со всеми значениями ![]() мы получим
список всех возможных термов.
мы получим
список всех возможных термов.
 Количество
S-термов и их знак
Количество
S-термов и их знак
![]()
Момент ![]() может быть получен,
если
может быть получен,
если ![]() =
=![]() или
или ![]() .
.
![]() Имеем
Имеем ![]() - угловые волновые функции атомов А и В.
- угловые волновые функции атомов А и В.
![]() Случай
Случай ![]() . Молекулярную функцию при
. Молекулярную функцию при ![]() можно
представить в виде линейных симметризованных и антисимметризованных комбинаций
(Ельяш., 725)
можно
представить в виде линейных симметризованных и антисимметризованных комбинаций
(Ельяш., 725)
![]()
![]() .
.
При отражении в плоскости проекция М меняет знак, и следоватально, Y+ - не меняется, а Y- - меняется.
Т.е, для каждого значения М существуют ![]() термы.
термы.
Число каждого из них равно L2 (при L1 L2) – всего 2 L2. (М=1,2,… L2)
![]() Случай
Случай ![]() . Один терм.
. Один терм.
Можно
показать (Ландау, 355), что ![]() будет если
будет если ![]() ,
,
S- – при ![]()
Здесь I1,2 = ±1 - четность состояний первого и второго атомов.
![]() Окончательно
Окончательно
Из
2L2 + 1 ![]() - термов получим
- термов получим
L2 + 1
термов ![]() и L2 термов
и L2 термов
![]() .
.

Молекулы, состоящие из одинаковых атомов
![]() Общее число состояний (2L2 + 1)(L1 + 1)
- если атомы, образующие молекулу, находятся в одинаковых состояниях.
Общее число состояний (2L2 + 1)(L1 + 1)
- если атомы, образующие молекулу, находятся в одинаковых состояниях.
Если атомы находятся в различных состояниях, то общее число возмущенных термов удваивается.
![]()
Число четных и нечетных термов (правило)
Пусть
Ng и Nu - число четных и
нечетных термов с данными ![]() и S.
и S.
Тогда:
если
![]() нечетно,
то Ng = Nu;
нечетно,
то Ng = Nu;
если
![]() четно
и S четно
(S = 0,2,4...), то Ng = Nu + 1;
четно
и S четно
(S = 0,2,4...), то Ng = Nu + 1;
если
![]() четно
и S нечетно
(S = 1,3,5...), то Nu = Ng +1;
четно
и S нечетно
(S = 1,3,5...), то Nu = Ng +1;
для ![]() термов:
термов:
если
S четно,
то 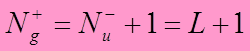 ;
;
если
S нечетно,
то 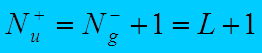 ;
;
(где L1 = L2 ºL).
![]() Все
Все 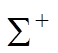 термы имеют четность (-1)S и все термы
термы имеют четность (-1)S и все термы ![]() - четность (-1)S+1.
- четность (-1)S+1.

Примеры
Молекула СО получается из атомов в состояниях 3P и 3P. (L1 = L2 = 1 и S1 = S2 = 1).
Полное
число термов с проекциями орбитального момента ![]() = 0; 1; 2
(2L + 1)(L +1) = (без учета
мультиплетности) равно 6
= 0; 1; 2
(2L + 1)(L +1) = (без учета
мультиплетности) равно 6
Полное количество термов с учетом мультиплетности S = 2, 1, 0. 18
![]() -термов 2L +
1
3
-термов 2L +
1
3
![]() -термов L1 + 1
2
-термов L1 + 1
2
![]() -термов L1
1
-термов L1
1
![]() -термов с
-термов с ![]() 2
2
D-термов с ![]() 1
1
![]() Окончательно, получим
Окончательно, получим 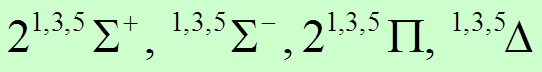 .
.
![]() Молекула Cl2 (2Р) может иметь следующие термы:
Молекула Cl2 (2Р) может иметь следующие термы:
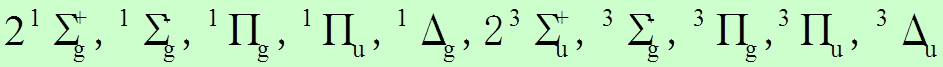
 |
|||
 |
|||
Образование связи спаренными электронами
· Выше в методе МО не учитывался спин.
· Принцип Паули (аналогично атомной системе):ВФ системы электронов, должна быть антисимметрична при перестановке любой пары электронов.
Пусть ![]() -
спиновые волновые функции молекулы.
-
спиновые волновые функции молекулы.
![]() Тогда полные собственные функции для молекулы Н2 :
Тогда полные собственные функции для молекулы Н2 :
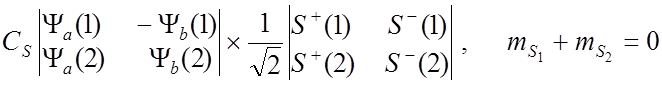
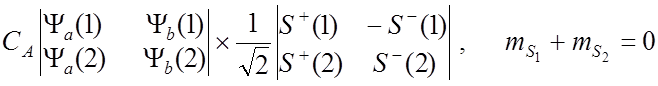
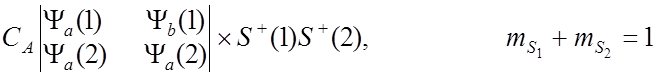
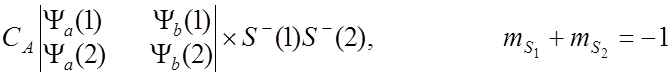
![]() имеют
собственные значения +1/2 и -1/2.
имеют
собственные значения +1/2 и -1/2.
![]() Только первое состояние соответствует устойчивому
состоянию молекулы водорода -
Только первое состояние соответствует устойчивому
состоянию молекулы водорода - ![]() , следовательно спин
устойчивого состояния равен нулю (спаренные электроны).
, следовательно спин
устойчивого состояния равен нулю (спаренные электроны).
В остальных трех случаях происходит отталкивание атомов.
![]() Метод валентной связи.
Метод валентной связи.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.