![]() (9.14).
В этом случае удельная константа для заданных начальных состояний iи jимеет вид
(9.14).
В этом случае удельная константа для заданных начальных состояний iи jимеет вид
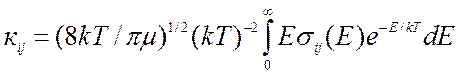 (9.15),
где
(9.15),
где ![]() соответствующая удельная функция
возбуждения. Полная константа скорости химической реакции получается путем
усреднения (9.15) на основе больцмановской функции распределения по внутренним
степеням свободы
соответствующая удельная функция
возбуждения. Полная константа скорости химической реакции получается путем
усреднения (9.15) на основе больцмановской функции распределения по внутренним
степеням свободы ![]() . Выражение для
. Выражение для ![]() имеет вид
имеет вид
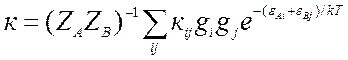 (9.16).
Здесь
(9.16).
Здесь ![]() статистические суммы по внутренним
степеням свободы каждого из реагентов.
статистические суммы по внутренним
степеням свободы каждого из реагентов.
Теория переходного состояния.
Один из главных недостатков теории столкновений – необходимость расчета зависящего от энергии сечения реакции. Для этого требуется знание потенциальной поверхности реакции и проведение сложных вычислений методами квантовой теории рассеяния. Поэтому значительный интерес представляет получение простых феноменологических моделей описания химических реакции. Здесь наибольшее распространение получил метод переходного состояния (МПС), называемый также методом активированного комплекса.
Для того чтобы произошел элементарный акт химического превращения, скажем обмен атомами при столкновении молекулы ХУ с молекулой WZ
![]() (9.17)
(9.17)
 необходимо,
чтобы произошло тесное сближение молекул реагентов. При тесном сближении частиц
между ними (независимо от типа реакции), как правило, возникают силы
отталкивания, для преодоления которых требуется определенная энергия. Можно
сказать, что для превращения должен быть преодолен потенциальный барьер.
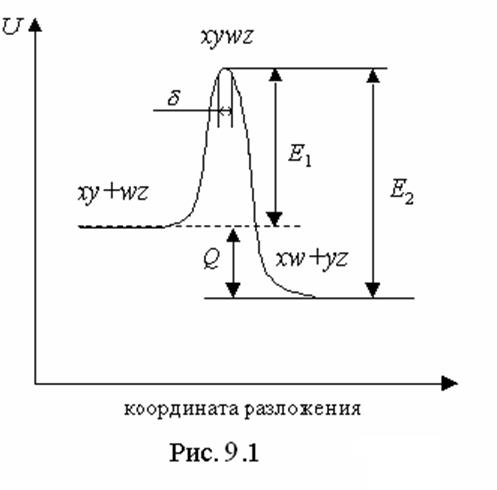
Схематически это представлено на Рис. 9.1. Здесь для определенности
предполагается, что прямой процесс экзотермичен: разность энергий между
начальным и конечным состояниями равна энергетическому выходу реакции Q.
Из. рис. 9.1 видно, что реакция активации обратного процесса
необходимо,
чтобы произошло тесное сближение молекул реагентов. При тесном сближении частиц
между ними (независимо от типа реакции), как правило, возникают силы
отталкивания, для преодоления которых требуется определенная энергия. Можно
сказать, что для превращения должен быть преодолен потенциальный барьер.
Схематически это представлено на Рис. 9.1. Здесь для определенности
предполагается, что прямой процесс экзотермичен: разность энергий между
начальным и конечным состояниями равна энергетическому выходу реакции Q.
Из. рис. 9.1 видно, что реакция активации обратного процесса ![]() превышает энергию активации прямого процесса
превышает энергию активации прямого процесса
![]() на величину энергии реакции Q.
Соответственно скорость обратной эндотермической реакции гораздо резче
(согласно закону Арениуса) зависит от температуры, чем скорость прямой,
экзотермической реакции.
на величину энергии реакции Q.
Соответственно скорость обратной эндотермической реакции гораздо резче
(согласно закону Арениуса) зависит от температуры, чем скорость прямой,
экзотермической реакции.
Уравнение кинетики для процесса (9.17) с учетом как прямой, так и обратной реакции можно записать:
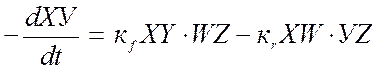 (9.18),
(9.18),
здесь
под символами ![]() понимаются их концентрации.
понимаются их концентрации.
Константы скоростей реакции, зависящие только от температуры, связаны принципом детального равновесия:
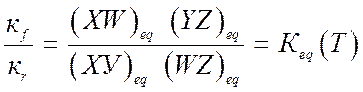 (9.19).
(9.19).
Основная идея МПС заключается в том, что вблизи
максимума потенциальной поверхности взаимодействия происходит тесное сближение
частиц реагентов и в этой области с линейными размерами ![]() (Рис.
5.1) порядка молекулярных, атомы образуют нечто подобное молекуле. Такое
состояние получило название активированного комплекса. Далее реакция протекает
через этот четко охарактеризованный (в смысле строения и частот) комплекс. Для
реакции (9.17) это будет выглядеть как
(Рис.
5.1) порядка молекулярных, атомы образуют нечто подобное молекуле. Такое
состояние получило название активированного комплекса. Далее реакция протекает
через этот четко охарактеризованный (в смысле строения и частот) комплекс. Для
реакции (9.17) это будет выглядеть как
![]() (9.20).
Предполагается, что реагенты, продукты и переходной комплекс находятся в
состоянии термодинамического равновесия и концентрации их однозначно связаны
(9.20).
Предполагается, что реагенты, продукты и переходной комплекс находятся в
состоянии термодинамического равновесия и концентрации их однозначно связаны
![]() (9.21).
(9.21).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.