где
![]() независящие от температуры параметры,
независящие от температуры параметры, ![]() абсолютная газовая постоянная.
Представление константы скорости реакции в виде (9.6) получило название закона
Аррениуса. Однако в ряде случаев эксперименты дают более сложную
зависимость константы скорости реакции от температуры чем (9.6). В этих случаях
более адекватное описание достигается с помощью выражения
абсолютная газовая постоянная.
Представление константы скорости реакции в виде (9.6) получило название закона
Аррениуса. Однако в ряде случаев эксперименты дают более сложную
зависимость константы скорости реакции от температуры чем (9.6). В этих случаях
более адекватное описание достигается с помощью выражения
![]() (9.7).
(9.7).
Говорят,
что уравнение (9.7) и другие формы температурной зависимости ![]() , отличные от (9.6), описывают
неаррениусово поведение.
, отличные от (9.6), описывают
неаррениусово поведение.
Константа скорости химической реакции в равновесных условиях является существенно макроскопическим параметром, результатом усреднения по множеству отдельных микроскопических событий. Ниже мы рассмотрим два способа определения константы скорости реакции: на основе теории столкновений и метода переходного состояния.
Теория столкновений.
В
основе теории столкновений бимолекулярных реакций лежит идея о том, что
молекулярные превращения в процессе столкновения характеризуются сечением
реакции. Рассмотрим реакцию между двумя частицами реагентов ![]() , движущимися с относительной скоростью
, движущимися с относительной скоростью ![]() . Скорость реакции
. Скорость реакции ![]() есть
произведение концентрации реагента A на
вероятность превращения в единицу времени
есть
произведение концентрации реагента A на
вероятность превращения в единицу времени ![]()
 (9.8).
(9.8).
wпо сути дела есть некоторая эффективная частота соударений, которая согласно (3.12) есть
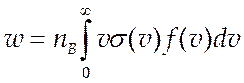 (9.9).
Здесь
(9.9).
Здесь ![]() соответствующее сечение реакции, а
соответствующее сечение реакции, а ![]() функция распределения по относительным
скоростям. Подставив (9.9) в (9.8) получим
функция распределения по относительным
скоростям. Подставив (9.9) в (9.8) получим
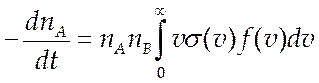 (9.10),
откуда константа скорости реакции есть
(9.10),
откуда константа скорости реакции есть
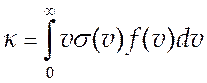 (9.11).
(9.11).
Уравнение (9.11) является основным в теории столкновений. Практически всегда при химических реакциях для поступательных степеней свободы выполняется условия ЛТР и в качестве функции распределения по относительным скоростям можно взять функцию распределения Максвелла (3.9). Тогда из (9.11) будем иметь
![]() (9.11),
где
(9.11),
где ![]() приведенная масса реагентов. Уравнение (9.11)
обычно представляют через поступательную энергию относительного движения
приведенная масса реагентов. Уравнение (9.11)
обычно представляют через поступательную энергию относительного движения ![]()
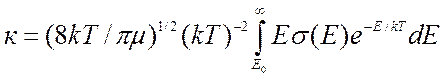 (9.12),
где нижний предел интегрирования
(9.12),
где нижний предел интегрирования ![]() соответствует энергии
порога реакции, определяемой как энергия относительного движения, ниже которой
сечение реакции равно нулю
соответствует энергии
порога реакции, определяемой как энергия относительного движения, ниже которой
сечение реакции равно нулю
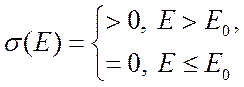 (9.13).
(9.13).
Как
правило, большинство столкновений являются такими, поскольку условие ![]() выполняется только для частиц в
высокоэнергетическом «хвосте» функции распределения. Связь между энергией
активации
выполняется только для частиц в
высокоэнергетическом «хвосте» функции распределения. Связь между энергией
активации ![]() и
и ![]() можно
получить из сопоставления выражений (9.12) с (9.6) или (9.7). Сечение
можно
получить из сопоставления выражений (9.12) с (9.6) или (9.7). Сечение ![]() определяется либо на основе
экспериментальных результатов, либо теоретически при соответствующем задании
потенциалов взаимодействия.
определяется либо на основе
экспериментальных результатов, либо теоретически при соответствующем задании
потенциалов взаимодействия.
Основное
выражение теории столкновений для константы скорости (9.12) может быть обобщено
на случай возбуждения внутренних степеней свободы. Пусть реагенты ![]() находятся в заданных квантовых состояниях
iи
j соответственно:
находятся в заданных квантовых состояниях
iи
j соответственно:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.