Новосибирский государственный университет
Изучение кинетического изотопного эффекта
в реакции азосочетания
Выполнили:
Ст. 041 гр. Брындин Вадим Евгеньевич
Ст. 041 гр. Живонитко Владимир Валерьевич
Проверил:
Новосибирск 2003
1. Цель работы
Изучение кинетического изотопного эффекта на примере реакции азосочетания.
2. Приборы и оборудованиe
Дикалиевая соль 2-нафтол-6,8-дисульфокислоты ( Г-соль ), 1-дейтеро-2-нафтол-6,8-дисульфокислота ( 0,019г ), диазосоль п-Br-анилина, нитрит натрия, раствор «В» - 0,05 Н раствор γ – пиколина в буфере, буферный раствор, спектрометр для видимой области, кювета 1 см.
3. Теоретическая часть:
а) Кинетический изотопный эффект
Кинетическим изотопным эффектом (КИЭФ) называют изменение скорости реакции при изменении изотопного состава. КИЭФ определяется как отношение константы скорости реакции частицы, содержащей легкий изотоп, к константе скорости частицы, содержащей тяжелый изотоп (KH/KD).
Изотопный эффект особенно велик в случае изотопов водорода, для которых различие в массах наибольшее. Ковалентная связь с дейтерием прочнее связи с протием (Н1), и реакция, в которой разрыв этих связей определяет скорость взаимодействия, должна быть более медленной в случае дейтерированного соединения. Наличие изотопного эффекта может быть использовано в качестве критерния разрыва связи с водородом в одной из стадий химической реакции.
Если KH и KD – константы скорости реакции частиц, содержащих легкий и тяжелый изотоп. Метод активированного комплекса дает следующие выражения для констант скоростей:
KH = (kТ/ћ)×(ZH#/ZA(H))×exp(-Ea/RT)
KD = (kТ/ћ)×(ZD#/ZA(D))×exp(-Ea/RT)
где KD и KH – константы скорости реакций, содержащих тяжелый и легкий изотоп. Отсюда
KH/KD = ((ZH#×ZA(D))/(ZD#×ZA(H)))×exp(-(EaH-EaD)/RT)
В первом приближении можно считать, что все колебательные степени свободы частицы А сохраняются в активированном комплексе, за исключением одной, которая переходит в поступательное движение вдоль координаты реакции. Пусть частота отвечающая этому колебанию, есть υ, а частота остальных колебаний υ1, υ2,… υi. Если считать, что частоты колебаний при превращении исходной частицы в активированный комплекс изменяются незначительно (υiH ≈ υi), то
ZK#/(ZA)K = 1/ZK = 1 – exp(-ћυ/RT)
Видно, что отношение колебательных статистических сумм равно
(ZH#)К(ZА(D))/(ZD#)К(ZA(H))К = (1 - exp(-ћυH/RT))/(1 - exp(-ћυD/RT))
Тогда, если ћυ/RT >> 1, то
KH/KD = exp(-(EaH-EaD)/RT)
Если в ходе реакции разрывается связь R-H, т.е. реакция идет по схеме
R-H + X → R…H…X → R + H-X
R-D + X → R…H…X → R + H-D,
Для реакций, идущих по выше приведенному типу,
υH/υD ≈ √2
Энергия активации может быть представлена как разность нулевых энергий активированного комплекса и исходных частиц.
Ea = Eo# - Eo; выражая Eo# и Eo через частоты колебаний, получим
Ea = Е + 1/2ћ∑( υi# – υi ) – 1/2ћυ,
где υi – все колебания по разрываемой связи (υ) , Е – высота потенциальнго барьера реакции. Высота потенциального барьера без учета вклада нулевых энергий не зависит от изотопного состава реагирующих частиц. Поэтому, считая υi# = υi, можно написать для реакций с разрывом связи R-H,
Ea(H) - Ea(D) = 1/2ћ( υRD – υRH ) =1/2ћυRH( 1/√2 – 1 ) = -0,15 ћυRH.
Изотопный эффект в таких реакциях
KH/KD = ((1 – exp(-ћυRD/RT))/(1 – exp(-ћυRH/RT)))×exp(0,15ћυRH/RT)
Изотопный эффект дейтерия может быть весьма значительным. Величина 0,15ћυRH может достигать значения в 1,4ккал/моль, а величина 0,15ћυRH/RT при комнатной температуре 10.
При изменении изотопного состава растворителя может наблюдаться другой изотопный эффект, но в данной работе изучается только выше изложенный.
б) Реакция азосочетания 2-нафтол-6,8-дисульфокислоты дикалиевой соли с диазосолью.
Вышеуказанная реакция идет в буферном растворе при постоянном значении pH=7.
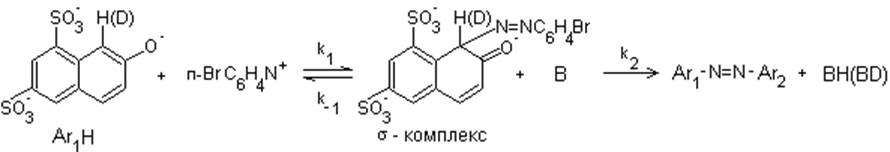
Здесь В – основание (γ – пиколин или др.)
Реакция замедляется в случае замены H на D в Ar1H, KH/KD = 7, это свидетельствует о том, что лимитирующей стадией является разрыв связи С-Н или С-D в σ-комплексе. В данной задаче кроме изотопного эффекта изучается каталитическое влияние основания В.
Для изучения механизма реакции можно воспользоваться методом квази-стационарных концентраций, считая, что промежуточной лабильной частицей является σ-комплекс:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.