ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Равновесия в гетерогенных системах, в которых не происходит химического взаимодействия между компонентами, а осуществляются лишь процессы перехода компонентов из одной фазы в другую (или другие) называются фазовыми равновесиями.
Термодинамические системы разделяют на гомогенные и гетерогенные.
Системой в химической термодинамике называют вещество или группу обособленных, находящихся во взаимодействии веществ.
Гомогенная система (от греч. homogenes - однородный) - это однофазная система , в любой точке которой в любой момент времени все свойства одинаковы. Например, смесь газов или раствор веществ.
Гетерогенная система (от греч. heterogenes - разнородный) - это система из двух или нескольких фаз, отличающихся по свойствам и соприкасающихся по поверхности раздела.
Фаза - это совокупность гомогенных частей гетерогенной системы с одинаковыми физическими и химическими свойствами во всем объеме. Фаза отделена от других частей системы поверхностью раздела, при переходе через которую свойства изменяются скачкообразно. Простейшей гетерогенной системой является однокомпонентная система, например, химически индивидуальное вещество в двух агрегатных состояниях (твердая соль и ее насыщенный раствор, жидкость и ее насыщенный пар, две ограниченно смешивающиеся жидкости, твердый йод я его пар, ромбическая и моноклинная сера).
Процесс перехода системы из одной фазы в другую или другие называется фазовым превращением. Это процессы плавления, кристаллизации, испарения, кипения, конденсации, сублимации (возгонки) и полиморфные превращения.
Температура фазового превращения не зависит от количества равновесных фаз и, являясь величиной постоянной Т.^ coast, зависит только от давления
га - f(P). Зависимость температуры от давления для фазовых превращений
была установлена Клапейроном в 1834 г. и обоснована Клаузисом в 1850 г. ' Дифференциальная форма уравнения Клапейрона-Клаузиса имеет вид
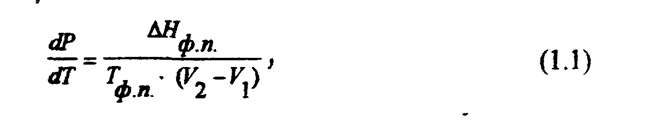
Ниже приведены уравнения Клапейрона-Клаузиса для частных случаев фазовых превращений.
Для процессов испарения и конденсации
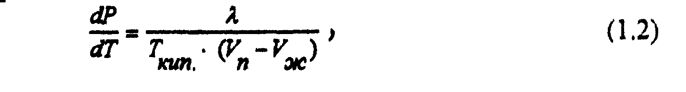
Испарение - это фазовый переход на границе раздела жидкость - пар или процесс парообразования со свободной поверхности жидкости.
Кипение - это процесс, когда парообразование происходит не только с поверхности, но и внутри жидкости путем образования пузырьков пара во всем объеме жидкости и выделения их. При этом давление в пузырьках пара, находящихся в равновесии с жидкостью, равно давлению над жидкостью.
Температура кипения - это температура, при которой давление
насыщенного пара жидкости равно внешнему давлению :
Уравнение Клапейрона -Клаузиса (1.2.) можно преобразовать, приняв следующие приближения:
2 - При не высоких давлениях и температурах (вдали от критических) можно применять уравнение состояния идеального газа -(уравнение Клапейрона - Менделеева ) и к реальным системам.
Тогда

где R - универсальная газовая постоянная. Подставив (1.6) в (1.2), получим

Это уравнение после преобразования

принимает вид

Теплота испарения А зависит от температуры: с повышением температуры она понижается, а с понижением - повышается; при критической температуре А = 0.
При температурах, далеких от критической, изменения А малы и поэтому в небольшом интервале температур, теплоту испарения можно считать величиной постоянной ( А = const).
После преобразования этого равенства получают аналитическую форму уравнения Клапейрона-Клаузиса:

Интегрирование уравнения (1.9) с учетом того, что теплота кипения не зависит от температуры :

или

Выражение представляет уравнение прямой линии с угловым коэффициентом А в координатах lnP-1/Г (рис.1). Тангенс угла наклона прямой а с положительным направлением оси абсцисс дает значение углового коэффициента:
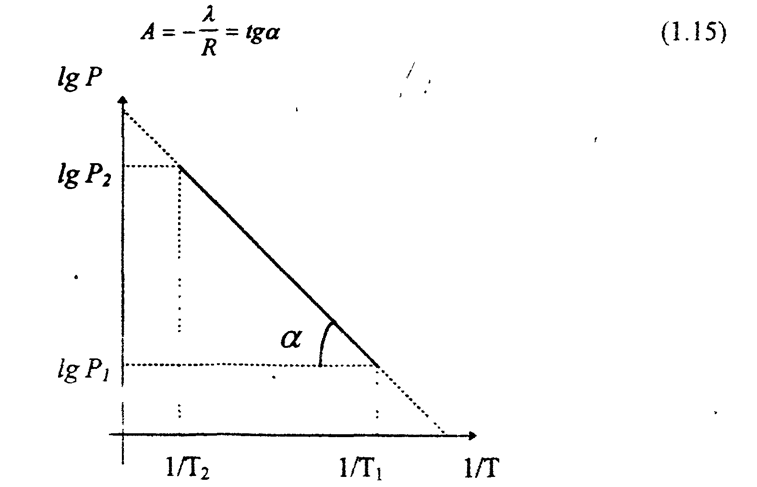
Рис. 1. Зависимость давления насыщенного пара от температуры
Чем больше угол а, тем больше теплота испарения, и следовательно, тем быстрее испаряется жидкость. Тангенс угла а находят из соотношения:
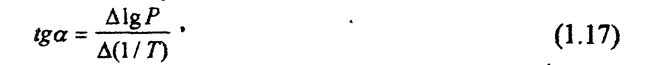
|
№ п/п |
t˚С |
Т, К |
1/Т |
ДАВЛЕНИЕ |
|||
Изм-е |
Атм. |
Ист. |
lg p |
||||
|
ЖИДКОСТЬ № 1 CH4COCH3 |
|||||||
|
1 |
34 |
304 |
0,00329 |
60 |
767 |
42,2 |
1,625 |
|
2 |
38 |
308 |
0,00324 |
50 |
52,2 |
1,718 |
|
|
3 |
43,5 |
313,5 |
0,00319 |
40 |
62,2 |
1,793 |
|
|
4 |
47,5 |
317,5 |
0,00315 |
30 |
72,2 |
1,858 |
|
|
5 |
51,5 |
321,5 |
0,00311 |
20 |
82,2 |
1,915 |
|
|
6 |
55 |
325 |
0,00307 |
10 |
92,2 |
1,965 |
|
|
7 |
57,5 |
327,5 |
0,00305 |
0 |
102,2 |
2,009 |
|
|
ЖИДКОСТЬ № 2 CCl4 |
|||||||
|
1 |
49.5 |
319.5 |
0.00313 |
60 |
42,2 |
1,625 |
|
|
2 |
50 |
320 |
0.00312 |
50 |
52,2 |
1,718 |
|
|
3 |
52.5 |
322.5 |
0.00310 |
40 |
62,2 |
1,793 |
|
|
4 |
55.5 |
325.5 |
0.00307 |
30 |
72,2 |
1,858 |
|
|
5 |
59 |
329 |
0.00303 |
20 |
82,2 |
1,915 |
|
|
6 |
62 |
332 |
0.00301 |
10 |
92,2 |
1,965 |
|
|
7 |
65 |
335 |
0.0029 |
0 |
102,2 |
2,009 |
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.