




Цель работы: определение коэффициента распределения вещества между двумя несмешивающимися или ограниченно смешивающимися растворителями.
1. ЗАКОН РАСПРЕДЕЛЕНИЯ
Если в систему, состоящую из двух несмешивающихся или ограниченно смешивающихся жидкостей, добавить третье вещество, способное растворяться в каждой из этих жидкостей, то это вещество будет распределяться между обеими жидкостями в соответствии с условием фазового равновесия.
При этом каждая из обеих фаз системы будет состоять из трех компонентов.
В состоянии равновесия химический потенциал растворенного вещества (компонента) одинаков в обоих растворах (фазах), то есть
μ(1)=μ(2), (1),
где μ(1) и μ(2) химические потенциалы растворенного компонента соответственно в первой и второй фазах. Так как
μ=μ°+ RTlna, (2),
где а - активность растворенного компонента, то
μ°(1)+ RTlna(1) = μ°(2)+ RTlna(1) (3),
Отсюда следует, что
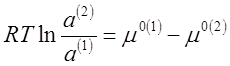 (4),
(4),
но так как разность μ°(1)- μ°(2) при постоянной температуре величина постоянная, то
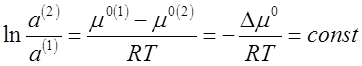
где Δ μ° - разность стандартных химических потенциалов растворенного вещества в первой и второй фазах.
Из соотношения (5) получают:
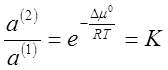
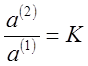 (7),
(7),
где К - коэффициент распределения; величина, постоянная при данной температуре.
Выражение (7) является количественным выражением закона распределения, который формулируется следующим образом:
Отношение активностей растворенного вещества при равновесном распределении его между двумя несмешивающимися или ограниченно смешивающимися растворителями при данной температуреесть величина постоянная при различных количествах растворенного вещества.
Из уравнения (6) следует, что коэффициент распределения не зависит от активностей растворенного вещества в обоих растворителях, но зависит от температуры, природы растворенного вещества и природы растворителя.
Зависимость коэффициента распределения от температуры определяется уравнением, аналогичным уравнению изобары химической реакции:
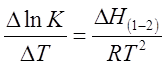 (8),
(8),
где Δ Н(1-2) (кДж/моль) - изменение энтальпии при переходе распределяемого вещества из одной фазы в другую (в данном случае - из первой во вторую).
Закон распределения справедлив только в том случае, когда добавление третьего вещества в систему из двух несмешивающихся или (ограниченно смешивающихся жидкостей не вызывает изменения растворимости этих жидкостей друг в друге.
Для разбавленных растворов, вместо отношения активностей, можно использовать отношение мольных долей:
![]()
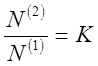 (9)
(9)
где N(1) и N(2) - мольные доли растворенного компонента в обеих фазах. Или отношение концентраций:
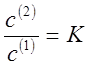 (10),
(10),
где с(1) и с(2) - молярные концентрации растворенного вещества (моль/л).
Если в растворе присутствует несколько невзаимодействующих веществ, то распределение каждого из растворенных веществ между двумя фазами определяется индивидуальным коэффициентом распределения, величина которого не зависит от присутствия других веществ.
Для малорастворимых веществ даже насыщенные растворы остаются разбавленными и подчиняются законам предельно разбавленных растворов.
Поэтому
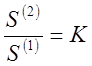 (11),
(11),
где S(1) и S(2) - концентрации насыщенных растворов (растворимости) малорастворимого компонента в обеих фазах.
Справедливость этого соотношения будет понятна, если учесть, что химические потенциалы растворенного компонента в обоих насыщенных растворах равны химическому потенциалу чистого компонента, то есть равны между собой.
Уравнение (10) довольно хорошо оправдывается в тех случаях, когда количество частиц распределяющегося компонента одинакова в обеих фазах, то есть нет ни диссоциации, ни ассоциации частиц.
Рассмотрим два простейших предельных случая.
1. Если распределяемое вещество диссоциирует во втором растворителе практически полностью на две частицы, то закон распределения справедлив в форме
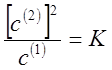 (12).
(12).
2. Если распределяемое вещество во втором растворителе ассоциировано в двойные частицы и степень ассоциации близка к единице, то закон распределения принимает вид
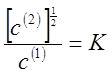 (13)
(13)
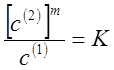 (14)
(14)
где m - величина, постоянная для определенной системы при постоянной температуре.
Все отклонения от законов идеальных растворов учитываются коэффициентами активности. Поэтому, если известны активности распределяемого компонента в двух растворителях, то уравнением (7) можно пользоваться и при диссоциации, и при ассоциации молекул в растворе.
Часто на практике вычисление коэффициента распределения производят по одной из формул (10), (12) или (13) (если известно, что в одной из фаз растворенное вещество не диссоциирует и не ассоциирует), выбирая ту из них, которая дает более постоянные значения К при различных концентрациях.
Экспериментальное определение коэффициентов распределения может служить для определения степени ассоциации или диссоциации растворенного вещества в том или ином растворителе ___________ изучения химических равновесии в растворе. Последнее применимо в тех случаях, когда только один из участников реакции, происходящей в первой фазе, способен растворяться во торой фазе. Для этого система доводится до состояния равновесия и по концентрации вещества во второй фазе рассчитывается его равновесная концентрация в первой фазе, а следовательно, и константа равновесия реакции.
Из закона распределения вытекает, что вещество, растворённое в одном растворителе, можно извлечь из раствора, добавляя к нему второй растворитель, несмешивающийся с первым. Такое извлечение растворенного вещества из раствора называется экстракцией.
2. ЭКСТРАКЦИЯ
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.