![]()
Температуру Т=0
называют абсолютным нулем, ему соответствует ![]()
Температура – это одна из макроскопических характеристик макросистемы. Она не имеет смысла для систем , состоящих из нескольких молекул.
1.3.Уравнение состояния идеального газа
Раскроем физический смысл и природу непосредственно наблюдаемых параметров состояния р,Т и других, исходя из молекулярно-кинетический представлений. При этом мы будем использовать статистический метод, интересуясь движением не отдельных молекул, а лишь такими средними величинами, которые характеризуют движение всей совокупности молекул.
 Уравнение состояния идеального газа позволяет
вычислять давление, объем, плотность и температуру ограниченного объема газа
любого
сорта.
Выведем уравнение состояния идеального газа. Будем считать молекулы
газа маленькими твердыми шарами, заключенными в ящик объема V. Это дает
нам возможность считать, что между молекулами происходит упругое соударение.
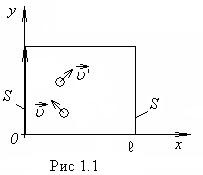
Рассмотрим сначала одну такую молекулу, отражающуюся от левой стенки ящика
(рис.1.1). Средняя сила, действующая на стенку на протяжении времени
Уравнение состояния идеального газа позволяет
вычислять давление, объем, плотность и температуру ограниченного объема газа
любого
сорта.
Выведем уравнение состояния идеального газа. Будем считать молекулы
газа маленькими твердыми шарами, заключенными в ящик объема V. Это дает
нам возможность считать, что между молекулами происходит упругое соударение.
Рассмотрим сначала одну такую молекулу, отражающуюся от левой стенки ящика
(рис.1.1). Средняя сила, действующая на стенку на протяжении времени ![]() t , равна
t , равна ![]() . В результате
удара о стенку импульс молекулы меняется на величину
. В результате
удара о стенку импульс молекулы меняется на величину
![]() -
удар абсолютно упругий. Время между соударениями молекулы с этой стенкой
-
удар абсолютно упругий. Время между соударениями молекулы с этой стенкой ![]() , тогда
, тогда ![]() .
.
В равновесном состоянии движение всех молекул
хаотично. Это позволяет считать, что все молекулы движутся только в направлениях
X,Y иZ, т.е. если в единице объема содержится п
молекул, то в каждом из этих направлений движутся по ![]() молекул,
или по
молекул,
или по ![]() в одну сторону.
в одну сторону.
Если в объеме содержится N молекул, то
результирующая сила, действующая на стенку со стороны всех молекул рана ![]() , где <ux2 > - средний квадрат скорости движения всех N
молекул в направлении Х.
, где <ux2 > - средний квадрат скорости движения всех N
молекул в направлении Х.
Величина, равная корню квадратному из <uX2 > называется среднеквадратичной скоростью молекулы в направлении Х.
Разделив обе части этого уравнения на площадь стенки S, получим выражение для давления:
![]() , где V
– объём газа (ящика).
, где V
– объём газа (ящика).
Мы получили, что для данной массы газа произведение pV остается постоянным при условии, что кинетическая энергия частиц остается без изменения (сохраняется). Это закон Бойля.
Молекулы газа движутся хаотически во всех направлениях, поэтому все направления в пространстве равноправны, и
![]() .
.
Ясно,
что ![]() , поэтому
, поэтому ![]() ,
,
тогда
![]() . (1.1)
. (1.1)
Это основное уравнение молекулярно - кинетической теории.
Абсолютной температурой принято называть величину, прямо пропорциональную средней кинетической энергии молекул в сосуде:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.