Записав результаты измерений и вычислив площадь поперечного сечения проволоки, приступают к ее растяжению. Поворачивая колок червячного механизма, постепенно увеличивают нагрузку(1, 2,3 и т.д. делений шкалы динамометра) и каждый раз наблюдают удлинения. Дойдя до 5-го деления, начинают вращать колок в обратную сторону, т.е. «снимать» нагрузку, следя за тем, как укорачивается проволока.
Убедившись, что проволока упруга, повторяют опыт и результаты наблюдений записывают в следующую таблицу:
|
Показания динамометра, 1∙9,8 Н |
Показания по шкале индикатора, мм |
Разность между удлинениями при двух последовательных нагрузках, мм |
|
1 |
||
|
2 |
||
|
3 |
||
|
4 |
||
|
5 |
||
|
4 |
||
|
3 |
||
|
2 |
||
|
1 |
По данным таблицы рассчитать модуль упругости материала проволоки.
Лабораторная работа №7
ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙПОСТОЯННОЙ
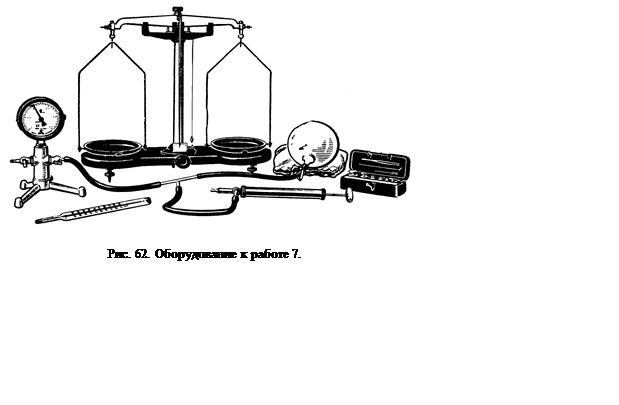
Оборудование: 1) шар для взвешивания воздуха с резиновым патрубком и винтовым зажимом; 2) манометр с пределами измерения от –1,0 до 1,5 атм; 3) термометр от 0 до 30˚С, 4) насос воздушный ручной; 5) весы технические (нагрузка до 1кг) с разновесами; 6) тройник стеклянный; 7) три резиновые трубки длиной по 20–30 см.
В предлагаемой работе определение универсальной газовой постоянной производится из сравнения двух различных состояний газа. Если масса m1 занимает в баллоне объем V1 при давлении р1 и температуре T1, то это состояние может быть описано уравнением Менделеева–Клапейрона:
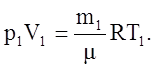 (1)
(1)
При изменении массы газа путем откачки или нагнетания его в баллон без изменения температуры образуется второе состояние газа, определяемое следующими параметрами: m2, p2, V1, T1. Уравнение Менделеева–Клапейрона для этого состояния можно записать так:
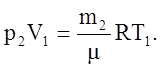 (2)
(2)
Вычитая из равенства (2) равенство (1), получим:
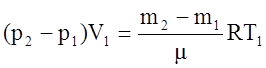
отсюда
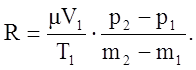
Здесь объем газа V1 и температура T1 для обоих состояний остаются постоянными. Давления p1 и p2 легко измеряются с помощью манометра. Для определения же разности m2–m1 достаточно произвести два взвешивания: определить массу баллона с газом для одного и другого состояний и найти разность между результатами взвешивания. Пусть, например, mб – масса баллона, тогда
![]() и
и ![]()
отсюда
![]()
где m' и m"– массы баллона с газом для соответствующих состояний, μ = 2,9·10-2 кг/моль.
Выполнение работы
Измеряют температуру воздуха в помещении. Записывают объем шара (объем обозначен на стенке шара, например, 1,23 дм3). Собирают установку. С помощью стеклянного тройника и резиновых трубок соединяют шар с манометром и откачивающим патрубком насоса. Медленно откачивая воздух, понижают давление в шире до 0,5 атм и надежно сжимают резиновый патрубок винтовым зажимом. Отсоединяют шар от установки и взвешивают его.
Для того чтобы получить второе состояние воздуха, отпускают зажим у шара и подключают его вновь к установке, а резиновую трубку с разрежающего патрубка насоса переставляют на нагнетающий. С помощью насоса доводят давление воздуха в системе до 1 атм. Снова сжимают патрубок у шара, отсоединяют шар от системы и взвешивают его. Опыт повторяют ещё 2–3 раза, увеличивая каждый раз давление на 0,5 атм и определяя массу шара с воздухом. Все результаты измерений заносят в таблицу:
|
№ опыта |
1 |
2 |
3 |
4 |
5 |
|
ρ, 104 Н/м2 |
|||||
|
m, 10-3 кг |
Пользуясь данными таблицы, вычисляют значение универсальной газовой постоянной R для каждого состояния, а затем ее среднее значение.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.