





Лекция 2
Термохимические эффекты в растворах электролитов
Как было найдено русским ученым Г. И. Гессом (1842), тепловые эффекты химических реакций в растворах электролитов обнаруживают известные аномалии. Так, теплоты нейтрализации сильных кислот сильными основаниями постоянны и не зависят (или , почти не зависят) от природы кислоты и основания, несмотря на то, что в результате их смешения образуются совершенно разные соли. Например, при нейтрализации раствора азотной кислоты раствором едкого кали
![]() (1-8)
(1-8)
получается раствор нитрата калия, а при нейтрализации раствора соляной кислоты раствором едкого натра
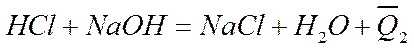 (1-9)
(1-9)
— раствор хлорида натрия. Несмотря на это, измеренные теплоты образования обеих солей практически одинаковы, т. е. Q1 = Q2 .Смешение растворов солей не связано с заметным тепловым эффектом, хотя в результате обменных реакций здесь могут образовываться новые соединения, как, например, при реакции между хлоридом калия и сульфатом натрия
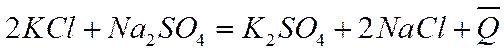
Для этой и многих других аналогичных реакций величины тепловых эффектов мало отличаются от нуля.
По теории электролитической диссоциации подобные опытныетермохимические закономерности следует отнести за счет того, что в воде, а также в ряде других растворителей соли, сильные кислоты и сильные основания почти полностью диссоциированы, т. е. для них ас = 1. При этих условиях реакция нейтрализации сводится к реакции образования воды из ионов Н+ и OH- ; катион же основания и анион кислоты сохраняются неизменными и присутствуют по-прежнему как свободные ионы. Действительно, если приведенные выше реакции нейтрализации переписать в ионном виде
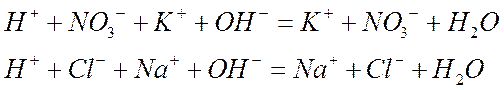
и сократить те частицы, которые не претерпевают изменения, то в обоих случаях фактически протекающим процессом будет реакция между ионами водорода и гидроксила
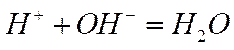 (1-12)
(1-12)
с характерным для нее тепловым эффектом. При смешении растворов различных солей, степень диссоциации которых близка к единице, в полученном растворе сохраняются свободные ионы, находившиеся в исходных растворах. Здесь не происходит химического превращения, а следовательно, не должно быть и теплового эффекта.
Химическое равновесие в растворах электролитов
Теория электролитической диссоциации позволила дать научное определение понятиям «кислота», «основание», создать теорию индикаторов, объяснить процессы ступенчатой диссоциации, гидролиза солей и т. д.
Ниже будут рассмотрены некоторые примеры приложения этой теории к химическому равновесию в растворах.
Электролитическая диссоциация воды. Диссоциация воды протекает по реакции
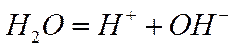 (1-13)
(1-13)
а константу ее диссоциации можно выразить как
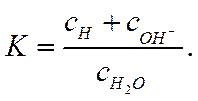 (1-14)
(1-14)
Поскольку степень диссоциации воды очень мала, то cн2о можно считать величиной постоянной и ввести ее в значение константы диссоциации, т. е.
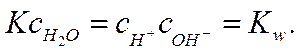 (1-15)
(1-15)
Уравнение (I-15) называется ионным произведением воды. При 25 °С Kw=10-14 и, следовательно,
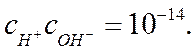
По теории электролитической диссоциации носителями кислотных свойств являются ионы водорода, а носителями основных свойств — ионы гидроксила. Раствор будет нейтральным, т. е. не кислым и не щелочным, когда cH+ = coh- = (Kw)1/2. При 25° С в нейтральном растворе Kw =10-14, cH+ = 10-7 г-ион/л и coh- = 10-7 г-ион/л. Если вместо концентрации использовать водородный показатель рН, введенный Зоренсеном (1909) и представляющий собой отрицательный десятичный логарифм концентрации водородных ионов (рН = — lg ch+), то нейтральному раствору будет отвечать рН = 7. При рН < 7 раствор кислый, при рН > 7 - щелочной.
Значение рН, равное 7, отвечает нейтральному раствору лишь при 25° С. При использовании шкалы рН следует иметь в виду, что константа диссоциации воды Kwв сильной степени зависит от температуры, увеличиваясь почти в сто раз в интервале от 20 до 100° С:
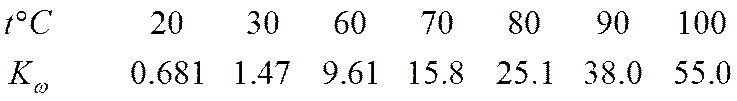
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.