Цель работы: экспериментально ознакомиться с основными видами коррозионных процессов и способами защиты металлов от коррозии
1. Теоретические сведения
Самопроизвольно протекающий процесс разрушения металлов вследствие химического или электрохимического взаимодействия его с внешней средой называется коррозией. Широко известны такие коррозионные явления, как ржавление железа на воздухе, образование окалины на железе при высокой температуре, разъедание металлов кислотами.
Коррозия - это окислительно-восстановительный процесс, в результате которого атомы электронейтрального металла превращаются в положительно заряженные ионы (катионы) под влиянием окружающей среды. Различают два вида коррозии: химическую и электрохимическую. Если окисление металла происходит как обычная химическая реакция, то коррозию называют химической. Примером может служить реакция
2Fe + 3Сl2 ® 2FeСl3,
t
4Fe + 3О2 ® 2Fe2O3.
Химическая коррозия развивается в не проводящей электрический ток среде.
Электрохимическая коррозия возникает при наличии разности потенциалов в электропроводящей среде, например при соприкосновении металлов с водой, растворами электролитов, атмосферным воздухом и другими влажными газами. В этих случаях процесс коррозии сопровождается перемещением электронов с одних участков металла к другим, т.е. появлением электрического тока. При этом на одних участках поверхности металла протекают катодные, а на других - анодные процессы. В качестве примера электрохимической коррозии рассмотрим действие H2SO4 на технический цинк, содержащий примеси железа.
На поверхности такого цинка возникает множество микроскопических гальванических элементов Zn || H2SO4 || Fe, в которых цинк служит анодом, а железо - катодом. На цинке протекает анодный процесс:
Zn0 ® Zn+2 + 2ē (окисление цинка).
Катодный процесс протекает на железе и связан с выделением водорода:
2Н+ + 2ē ® 2Н0 ® Н2 (восстановление водорода),
или в ионно-молекулярной форме:
2Н2О + 2ē ® Н2 + 2ОН-.
Обычно при электрохимической коррозии катодные процессы зависят от рН среды, если рН < 7 (кислая среда), то на катоде происходит выделение водорода (см. выше), при рН > 7 (нейтральная или основная среда) происходит ионизация (восстановление) кислорода, т.е. за катодный процесс отвечает вода и растворенный в ней кислород - они присоединяют электроны, образуя гидроксо- группу:
2H2O + O2 + 4ē ® 4ОН- (катодный процесс).
Таким образом, электрохимическая коррозия металлов - это результат действия микрогальванических элементов на их поверхности.
При описании коррозионных явлений окисляющийся металл называют анодом, а процесс окисления - анодным. Металл, на котором электроны переходят к окислителю, называют катодом, а процесс восстановления - катодным (по аналогии с гальваническими элементами).
В случае контакта разнородных металлов возникает разность потенциалов в результате различия стандартных электродных потенциалов этих металлов. При этом электрохимически более активный металл разрушается и становится анодом, а менее активный металл - катодом.
Однако даже на безукоризненно однородной поверхности металла, согласно уравнению Нернста:
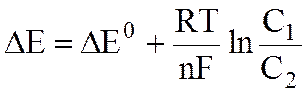 ,
,
могут образоваться анодные и катодные участки, если на различных частях поверхности различна концентрация электролита. Примером может служить электрохимическая коррозия вследствие неравномерной аэрации (насыщения воздухом). Замечено, что пластина металла, опущенная в воду, ржавеет так, как показано на рис 7.1, вследствие неодинаковой доставки кислорода к различным участкам поверхности металла. Участки металла, соприкасающиеся с раствором, содержащим больше кислорода, становятся катодами - в них металл не растворяется, а на металле происходит катодная реакция:
2Н2О + О2 + 4ē ® 4OН-.
Участки с меньшей концентрацией кислорода являются анодами и там начинается коррозия
Fe0 ® Fe2+ + 2ē.
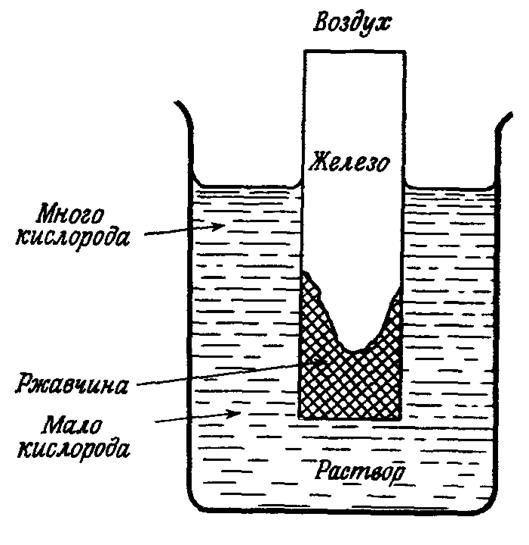
Рис. 7.1. Коррозия железа вследствие неравномерной аэрации
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.