Обозначения: (г) - газ, (ж) - жидкость, (т) - твердое (кристаллическое) вещество.
Растворение безводной соли можно рассматривать как совокупность одновременно протекающих процессов разрушения кристаллической решетки соли и гидратации образовавшихся ионов. Поэтому энтальпия реакции растворения DHраств. равна алгебраической сумме изменения энтальпии при разрушении кристаллической решетки DHкр.р. и изменения энтальпии при гидратации образовавшихся ионов DHгидр.
DHраств. = DHкр.р. + DHгидр..
Зная общую массу раствора mобщ, равную сумме массы соли mсоли и массы воды mводы, приняв удельную теплоемкость раствора Ср равной теплоемкости воды, т.е. 4.184 Дж/г·град, а его плотность равной единице, определите количества теплоты Qpаст, выделяющейся при растворении безводной соли в пересчете на 1 моль безводной соли по формулам (3.1) и (3.2).
Выполняется по заданию преподавателя по приведенным ниже условиям и данным табл. 3.3.
По уравнению DG = DH - TDS рассчитайте энергию Гиббса при Т = 298 К и при Т, заданной в табл. 3.3. Сделайте обоснованные выводы о возможности протекания реакции при этих температурах. Определите количество теплоты, поглощенной или выделенной при протекании реакции, в пересчете на заданное количество вещества.
4. Контрольные вопросы
1. Дать определение энтальпии химической реакции.
2. Дать формулировку закона Гесса и привести пример его применения для химических реакций, идущих через промежуточные стадии.
3. Что называется энтальпией образования и энтальпией разложения вещества?
4. Как можно рассчитать энтальпию химической реакции, если известны энтальпии образования исходных веществ и продуктов реакции?
5. Вычислите энтальпию реакции полного сгорания ацетилена С2Н2 (стандартные энтальпии образования см. в приложении 5).
6. Используя приложение 6, сравните энтальпии растворения безводных и гидратированных солей и сделайте вывод.
5. Литература
1. Коровин Н.В. Общая химия. – М.: Высш. шк., 2000. - С. 116-143.
2. Фролов В.В. Химия. – М.: Высш. шк., 1979. – С. 141-144.
Цель работы: научиться определять скорость реакции; ознакомиться с различными факторами, влияющими на скорость реакции, химическим равновесием.
1. Теоретические сведения
Раздел химии, изучающий скорость химических процессов и влияние на нее различных факторов, а также механизм реакций, называется химической кинетикой.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени.
Средняя скорость реакции вычисляется по формуле
Vср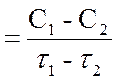 или DV =
или DV = 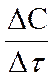 ,
,
где C1 - начальная концентрация вещества; С2 - конечная концентрация вещества; Dt - промежуток времени, за который изменилась концентрация от C1 до С2.
Истинная скорость реакции в данный момент определяется как производная от концентрации по времени:
Vист = 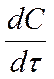 .
.
Рассматривая кинетику химических реакций, следует иметь в виду, что характер взаимодействия зависит от агрегатного состояния продуктов и реагентов.
Продукты и реагенты, вместе взятые, образуют физико-химическую систему. Совокупность однородных частей системы, обладающих одинаковым химическим составом и физическими свойствами, и отделенных от остальных частей системы поверхностью раздела, называется фазой.
Системы, состоящие из одной фазы, называются гомогенными, а системы, содержащие несколько фаз, - гетерогенными.
На скорость реакции влияют природа веществ, их концентрация, температура, присутствие катализатора.
Зависимость скорости гомогенной реакции от концентрации реагирующих веществ выражена в законе действия масс:
Скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Так, для реакции aA + bB D cC + dD закон действия масс записывается в следующем виде:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.