Частично смешивающиеся жидкости
К этой группе относятся многие технически важные смеси, например вода — изобутиловый спирт, вода — фенол, вода — изоамиловый спирт, вода — анилин, вода — фурфурол и др.
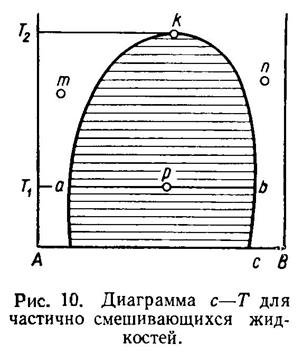
На рис. 10 представлена диаграмма с—Т для частично растворимых бинарных систем. Диаграмма построена для постоянного давления. Фигуративные точки, лежащие в заштрихованной части диаграммы, отвечают состоянию системы, при котором образуется два слоя. Вне заштрихованной области лежат фигуративные точки m, n, отвечающие гомогенным состояниям системы, т.е. состояниям, не образующим слоев различного состава.
 Если взять систему, фигуративной точкой которой будет
точка р, то жидкая фаза
этой системы будет расслаиваться на два слоя. Состав одного из этих слоев будет
изображаться точкой а, состав же
другого слоя — точкой b. Для нахождения
точек а и b нужно провести изотерму T1=const через точку р.
Если взять систему, фигуративной точкой которой будет
точка р, то жидкая фаза
этой системы будет расслаиваться на два слоя. Состав одного из этих слоев будет
изображаться точкой а, состав же
другого слоя — точкой b. Для нахождения
точек а и b нужно провести изотерму T1=const через точку р.
Для того чтобы найти весовые количества того или другого слоя, рекомендуется воспользоваться правилом рычага. Это правило формулируется так:
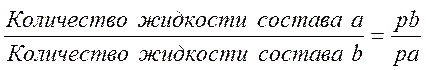
По мере того как повышается температура, изменяется состав сопряженных слоев. Состав их сближается, пока, наконец, не приходит в точку k, лежащую на изотерме Т2 = const. В этой точке состав двух слоев будет одинаковым, и система будет иметь уже не две жидкие фазы, а одну. Температура Т2 называется критической температурой, а точка k критической точкой.
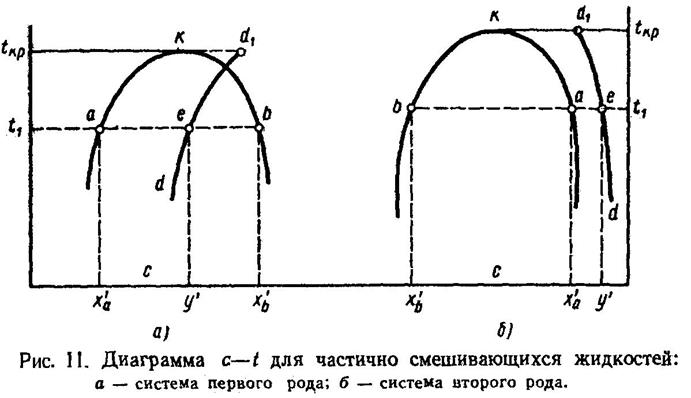 |
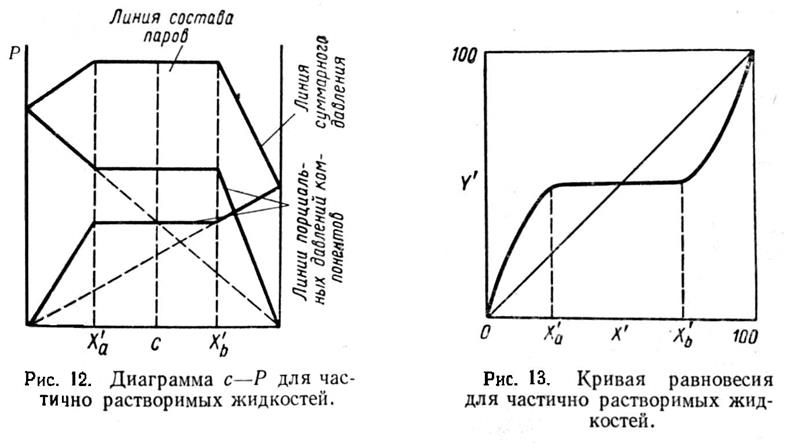
Типичная диаграмма с—Р при t = const для частично растворимых жидкостей представлена на рис. 12. На этой диаграмме изображены линии парциальных давлений каждого из компонентов и линия суммарного давления. На участке х'а — х'b, на котором имеется два слоя, парциальное давление остается постоянным. Остается постоянными суммарное давление паров компонентов. Таким образом, на участке х'а — х'b диаграмма имеет тот же вид, что и для нерастворимых жидкостей, а состав паровой фазы остается неизменным. Что касается кривой равновесия, то в типичном случае она может быть представлена такой, какая изображена на рис. 13. Такого типа кривую равновесия будет иметь, например, система фурфурол — вода, относящаяся к системам группы «а»
 |
Диаграммы состояния бинарных систем
Кроме диаграмм с—Р и X¢—Y¢, в науке о ректификации широко применяются диаграммы «состав—температура» (t—X—Y) и «тепловая диаграмма» (I—X).
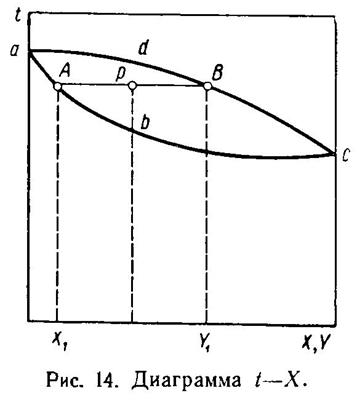 Диаграмма «состав — температура» строится в координатах t—(X, Y), как это показано на рис. 14. Давление в системе
принимается постоянным; следовательно, кривые, изображенные на рисунке, изобары. Линия abc носит название температурной кривой и дает
температуру кипения данного состава (X) при заданном давлении. Линия adc называется линией конденсации и дает температуру конденсации при
заданном давлении смеси паров данного состава.
Диаграмма «состав — температура» строится в координатах t—(X, Y), как это показано на рис. 14. Давление в системе
принимается постоянным; следовательно, кривые, изображенные на рисунке, изобары. Линия abc носит название температурной кривой и дает
температуру кипения данного состава (X) при заданном давлении. Линия adc называется линией конденсации и дает температуру конденсации при
заданном давлении смеси паров данного состава.
Сопряженные точек А и В лежат на одной изотерме. При этом точка А дает состав жидкой фазы X1, а точка В — состав равновесной паровой фазы У1. Область диаграммы, лежащая между линиями abc и adc, является областью влажного пара, содержащего жидкую фазу. Какая-либо точка р, лежащая в этой области на изотерме АВ, соответствует системе, в которой содержится и пар и жидкость. При этом пар имеет состав Y1, а жидкость X1. Количество пара и жидкости находится по правилу рычага:
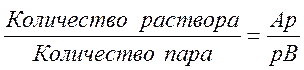
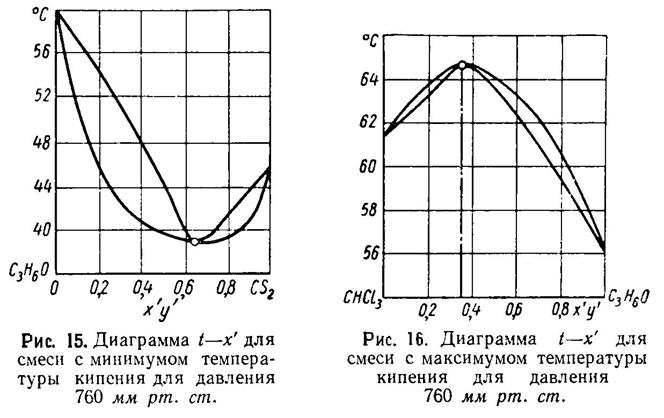 |
В случае, когда рассматриваемые системы образуют азеотропную смесь, на диаграмме появляется точка, в которой линия температур и линия конденсации пересекаются (рис. 15).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.