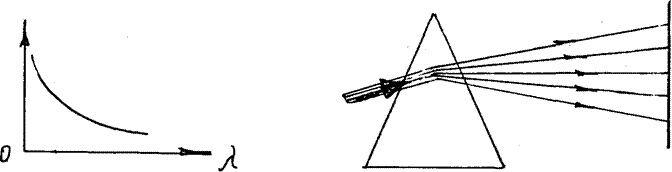
На границе раздела двух сред волны преломляются. Как показывают опыты, волны различной длины имеют различный показатель преломления, т.е. различную скорость распространения. Чем больше длина волны, тем меньше показатель преломления (рис. 13) Значит, в веществе длинные волны имеют большую скорость, чем короткие (рис. 14)
Зависимость скорости распространения волны или показателя преломления вещества от длины волны называется дисперсией.
Дисперсия хорошо наблюдается при прохождении света через трехгранную призму (рис.15)
В результате дисперсии световые волны после прохождения призмы располагаются упорядоченно, и на экране образуется цветная полоска, состоящая из семи цветов, т.е. спектр. Цвета непрерывно переходят один в другой, т.е. спектр белого света сплошной. Если отдельные цвета спектра снова смешать, например, с помощью зеркал, то получим снова белый свет.
Знание спектра позволяет объяснить цвета прозрачных и непрозрачных тел. Свет, падая на вещество, взаимодействует с ним, при этом какие - то длины волн могут поглощаться, а другие отражаться, третьи - проходить через вещество, что и будет определять цвет тела. Если прозрачный предмет имеет, например, синий цвет, то он поглощает все лучи, кроме тех, которые относятся к синему диапазону и т.д. Аналогично объясняется и цветность непрозрачных тел.
|
||||||
|
|
|||||
Типы спектров. Объяснение спектров.
Спектральный анализ
Спектры самосветящихся тел называют спектрами испускания. Они делятся на сплошные и линейчатые.
Сплошной спектр получается от светящихся твёрдых тел, жидкостей и газов, находящихся под высоким давлением.
Линейчатые спектры получаются от светящихся разреженных газов.
Если у сплошного спектра одна цветность плавно переходит в другую, то линейчатые представляют собой отдельные яркие полоски различного цвета. Это значит, что разреженные газы испускают не все длины волн, а лишь некоторые.
Кроме спектров испускания можно наблюдать спектры поглощения. Они образуются тогда, когда на пути белых лучей находятся разреженные газы. В этом случае на фоне сплошного спектра появятся тёмные полосы, т.е. атомы газа поглощают определённые частоты проходящего через них света. Немецкий физик Кирхгоф установил, что газ поглощает те длины волн, которые сам излучает.
Объяснение спектров стало возможным после работы Н. Бора, т.е. с квантовых позиций.
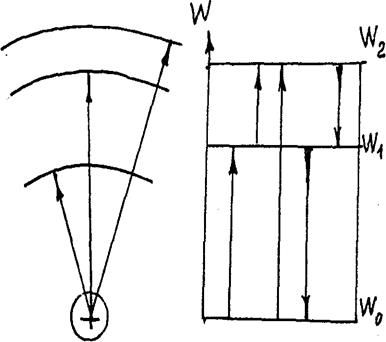
При переходе электронов с одной дозволенной орбиты на другую атом поглощает или испускает квант энергии, частота которого находится из уравнения Wm – Wn = hv
 |
|
Каждой частоте соответствует в спектре светящаяся полоска (линия). Из уравнения Бора ясно, что для одних и тех же уровней атом
излучает и поглощает одинаковые кванты, т.е. число линий и их расположение в спектрах испускания и поглощения соответствуют друг другу.
Происхождение сплошных спектров объясняется тем, что излучения твёрдыми и жидкими телами осуществляется не отдельными атомами, как в разреженных газах, а огромным количеством атомов, находящихся во взаимодействии друг с другом.
Так как энергетические переходы у каждого вещества индивидуальны, то каждому веществу соответствует свой линейчатый спектр. По линейчатым спектрам можно определить химический состав вещества. Такой анализ называют спектральным.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.